Fenylalanine -kenmerken, functies, biosynthese, voedsel
- 3359
- 103
- James Dach
De Fenylalanine (Phe, F) is een van de 9 essentiële aminozuren, dat wil zeggen, het wordt niet endogeen gesynthetiseerd door het menselijk lichaam. In zijn zijketen heeft dit aminozuur een niet -polaire aromatische verbinding die het kenmerkt.
Het fenylalanine, of β-fenyl-a-amino-propionzuur werd voor het eerst geïdentificeerd in 1879 door wetenschappers J. H. Schulze en M. Barbieri uit een plant uit de Fabaceae -familie bekend als Lupinus luteus of "Yellow Altramuz".
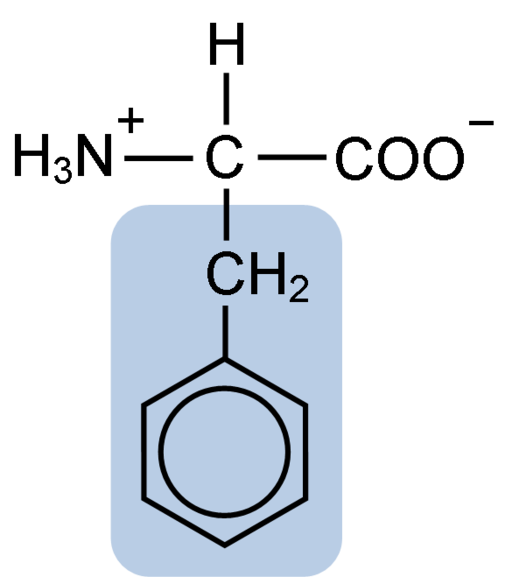
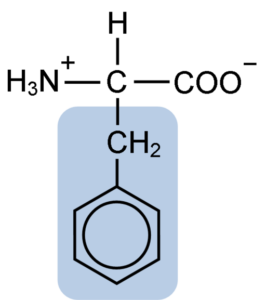 Chemische structuur van het aminozuurfenylalanine (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Chemische structuur van het aminozuurfenylalanine (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Het dipéptide L-fenylalanine-l-aspartil staat bekend als aspartaam of "nutrasweet", een zoetstof die synthetisch en veel wordt gebruikt in restaurants en coffeeshops, meestal om dranken zoals koffie, thee, thee, limonade en andere drankjes te drinken.
In fruit met verhitte kenmerken is de omzetting van l-fenylalanine in fenolesters zoals eugenol en zijn metilische derivaten wat aanleiding geeft tot de zoete bloemengeur of vergelijkbaar met de typische honing van bananen en bananen fruit wanneer ze volwassen zijn.
Afhankelijk van de vorm kan fenylalanine verschillende smaken hebben. De L-fenylalanine-vorm heeft bijvoorbeeld een zoet aroma en smaak, terwijl d-fenylalanine iets bitter is en meestal TOOD.
Omdat het een sterk hydrofoob karakter heeft, is fenylalanine een van de belangrijkste bestanddelen van veel van de harsen in de natuur, zoals polystyreen. Deze harsen vormen, wanneer ze in contact komen met watermoleculen, een beschermende of dekkingsstructuur die bekend staat als "Clatrato".
De genen die coderen voor de biosyntheseroute van fenylalanine worden door botanici gebruikt als evolutionaire horloges, omdat deze is vastgesteld dat deze gerelateerd zijn aan de morfologische diversificatie van terrestrische planten.
[TOC]
Kenmerken en structuur
Fenylalanine deelt met alle aminozuren de carboxylgroep (-coh), de aminogroep (-NH2) en het waterstofatoom (-H) die zijn bevestigd aan een centraal koolstofatoom dat bekend staat als koolstof α. Bovendien heeft het natuurlijk een zijketen of karakteristieke R -groep.
Fenylalanine is een van de drie aminozuren met aromatische of benzeenringen als substituenten in laterale ketens. Deze verbindingen zijn niet polair en zijn daarom zeer hydrofoob.
Het aminozuur in kwestie is vooral hydrofoob, omdat, in tegenstelling tot tyrosine en tryptofaan (de andere twee aminozuren met aromatische ringen) geen amino- of hydroxylgroepen hebben verenigd in zijn benzeenring.
De aromatische, benzoïsche of sandylalaninegroep fenylalanine heeft de typische benzeenstructuur: de cyclische ring is gestructureerd door 6 koolstofatomen die resonantie hebben vanwege de aanwezigheid van drie dubbele bindingen en drie eenvoudige bindingen binnen.
In tegenstelling tot tyrosine en tryptofaan, die respectievelijk een positieve en negatieve belasting kunnen verwerven, behoudt fenylalanine zijn neutrale belasting, omdat de benzeenring niet is geïoniseerd en de ladingen van carboxyl- en aminogroepen elkaar neutraliseren.
Classificatie
Aminozuren worden in verschillende groepen ingedeeld volgens de kenmerken die hun zijketens of R -groepen hebben, omdat ze kunnen variëren in grootte, structuur, functionele groepen en zelfs in elektrische lading.
Zoals vermeld, wordt fenylalanine geclassificeerd in de groep aromatische aminozuren, samen met tyrosine en tryptofaan. Al deze verbindingen hebben aromatische ringen in hun structuur, maar tyrosine en tryptofaan hebben ionbare groepen in de substituenten van hun R -groepen.
Kan u van dienst zijn: allopatrische speciatie: concept, proces en voorbeeldenDe eiwitlichtabsorptiekarakteristieken bij een golflengte van 280 nm zijn te wijten aan de aanwezigheid van de aminozuren die zijn geclassificeerd in de fenylalaninegroep, omdat ze gemakkelijk ultraviolet licht absorberen door hun aromatische ringen.
Er is echter aangetoond dat fenylalanine in veel minder verhouding absorbeert dan tyrosine en tryptofaan, dus bij de analyse van sommige eiwitten is de absorptie ervan voorspelbaar.
Stereochemie
Alle aminozuren hebben een centrale quirale koolstof, die vier verenigde atomen of groepen heeft en, zoals reeds gezegd, dit atoom wordt geïdentificeerd als koolstof α. Op basis van deze koolstof zijn er ten minste twee stereoisomeren van elk aminozuur te vinden.
Stereoisomeren zijn moleculen met spiegelende beelden, die dezelfde moleculaire formule hebben, maar die niet over elkaar overlappen, zoals bijvoorbeeld handen en voeten. De verbindingen die experimenteel het rechter gepolariseerde lichtvlak roteren, worden aangeduid met de letter D, en degenen die het links doen, met de letter L.
Het is belangrijk om commentaar te geven dat het onderscheid tussen de vormen van d-fenylalanine en L-fenylalanine de sleutel is om het metabolisme van dit aminozuur in het lichaam van gewervelde dieren te begrijpen.
De L-fenylalanine-vorm wordt gemetaboliseerd en geëxploiteerd voor de constructie van cel-eiwitten, terwijl D-fenylalanine in de bloedbaan is gevonden als beschermend middel tegen reactieve zuurstofspecies (ROS).
Functie
In de jaren 90 werd gedacht dat fenylalanine alleen in sommige plantensoorten was. Tegenwoordig is het echter bekend dat het aanwezig is in bijna alle hydrofobe domeinen van eiwitten, in feite is fenylalanine de belangrijkste component van de aromatische chemische soorten eiwitten.
In planten is fenylalanine een essentieel onderdeel van alle eiwitten; Bovendien is het een van de voorlopers van secundaire metabolieten zoals fenylpropanoïden (die deel uitmaken van de pigmenten) van defensieve moleculen, flavonoïden, biopolymeren zoals lignine en suberine, onder anderen.
Fenylalanine is de basisstructuur om veel van de moleculen te vormen die neuronale homeostase handhaven, waaronder peptiden zoals vasopressine, melanotropine en encefaline. Bovendien is dit aminozuur direct betrokken bij de synthese van het adrenocortopische hormoon (ACTH).
Zoals veel van eiwitaminozuren, maakt fenylalanine deel uit van de groep ketogene en glucogene aminozuren, omdat het het koolstofkelet van intermediairs van de Krebs -cyclus levert, noodzakelijk voor cel- en lichaamsenergiemetabolisme.
In overtollige, wordt fenylalanine omgezet in tyrosine en vervolgens in fumaraat, een intermediair van de Krebs -cyclus.
Biosynthese
Fenylalanine is een van de weinige aminozuren die niet kunnen worden gesynthetiseerd door de meeste geoorvullingsorganismen. Momenteel staan alleen biosynthetische routes bekend om dit aminozuur in prokaryotische organismen, in gisten, in planten en in sommige soorten schimmels.
De genen die verantwoordelijk zijn voor de syntheseroute zijn zeer bewaard tussen planten en micro -organismen, daarom heeft biosynthese vergelijkbare stappen in bijna alle soorten. Zelfs sommige enzymen op de route zijn bij sommige dieren aanwezig, maar deze kunnen het niet synthetiseren.
Biosynthese van fenylalanine in planten
Bij plantensoorten wordt fenylalanine gesynthetiseerd door een interne metabole route in de chloroplasten die bekend staan als "vooraf vaste route". Deze route is metabolisch gerelateerd aan "de shikimato-route", door de L-arogenato, een van de metabolieten geproduceerd tijdens de laatste.
Kan u van dienst zijn: topoisomerase: wat zijn, kenmerken, functies, typenHet inhydratasa Arewood -enzym katalyseert een reactie van drie stappen, waarin het de aromatische ring van het arogenaat transformeert in de karakteristieke benzenische ring van fenylalanine.
Dit enzym katalyseert een transaminatie, uitdroging en decarn.
Het voorland naast het geaccumuleerde fenylpyruvaat binnen (het licht) van de chloroplast, kan worden omgezet in fenylalanine door reactie gekatalyseerd door het enzym aminotransferase propenato, die een aminogroep overdracht geeft aan het fenylpyruvaat dus dat het wordt herkend door het arogenaat -dehydratase en is opgericht. tot de synthese van fenylalanine.
In sommige soorten van Pseudomonas Alternatieve routes zijn beschreven tot die van de Profenato, die verschillende enzymen gebruiken, maar waarvan de substraten voor de synthese van fenylalanine ook het voorafete en het arogenaat zijn.
Degradatie
Fenylalanine kan op meerdere manieren van voedsel worden gemetaboliseerd. De grootste hoeveelheid studies richt zich echter op hun bestemming op centrale zenuwweefselcellen en nierweefsels.
De lever is het belangrijkste orgaan voor afbraak of katabolisme van fenylalanine. In hepatocyten is er een enzym dat bekend staat als hydroxylase fenylalanine, in staat om fenylalanine te transformeren in tyrosine of in de verbinding L-3,4-dihydroxyfenylalanine (L-dopa).
De L-dopa-verbinding is een voorloper van norepinefrine, epinefrine en andere hormonen en peptiden met activiteit in het zenuwstelsel.
Fenylalanine kan worden geoxideerd in hersencellen door middel van het hydroxylase tyrosine-enzym, dat verantwoordelijk is voor het katalyseren van de omzetting van fenylalanine in dopacroom in aanwezigheid van L-askinezuur.
Eerder werd gedacht dat het hydroxylase tyrosine hydroxylase alleen tyrosine, echter werd gevonden dat deze fenylalanine- en tyrosine -hydroxyle in dezelfde verhouding en dat de hydroxylering van fenylalanine de hydroxylering van de tyrosine remt.
Op dit moment is het bekend dat hoge verhoudingen van tyrosine de enzymatische activiteit van hydroxylase tyrosine remmen, maar hetzelfde geldt niet voor fenylalanine.
Voedsel rijk aan fenylalanine
Alle eiwitrijke voedingsmiddelen hebben een fenylalaninegehalte tussen 400 en 700 mg voor het deel van het ingenomen voedsel. Voedingsmiddelen zoals kabeljauwolie, verse tonijn, kreeften, oesters en andere tweekleppige, bevatten meer dan 1.000 mg per deel van ingenomen voedsel.
Bovine en varkensvlees hebben ook hoge niveaus van fenylalanine. Ze zijn echter niet zo hoog als de concentraties die aanwezig zijn bij zeedieren. Bijvoorbeeld, spek, rundvlees, lever, kip en zuivelproducten hebben tussen de 700 en 900 mg fenylalanine door voedselrantsoen.
Noten zoals pinda's en noten van verschillende soorten zijn andere voedingsmiddelen met een goede hoeveelheid fenylalanine. Korrels zoals sojabonen, kikkererwten en andere peulvruchten kunnen per deel tussen 500 en 700 mg fenylalanine verschaffen.
Als een alternatieve bron kan fenylalanine worden gemetaboliseerd uit aspartaam.
Voordelen van uw inname
Fenylalanine wordt gevonden in alle eiwitrijke voedingsmiddelen die we consumeren. Het minimale dagelijkse consumptie voor volwassenen en de gemiddelde grootte is ongeveer 1000 mg, noodzakelijk voor eiwitsynthese, hormonen zoals dopamine, van verschillende neurotransmitters, enz.
Het kan u van dienst zijn: wat is de natuurlijke diversiteit van de aarde?De consumptie van dit overtollige aminozuur wordt voorgeschreven voor mensen die depressieve aandoeningen, gewrichtspijn en huidziekten hebben, omdat het consumptie de synthese van eiwit verhoogt en biomoleculen zoals epinefrine, norepinefrine en dopamine verhoogt.
Sommige studies suggereren dat fenylalanine die in overmaat worden geconsumeerd geen significante verbeteringen oplevert bij een van deze aandoeningen, maar hun conversie in tyrosine, die ook wordt gebruikt voor de synthese van signaalmoleculen, kan de positieve effecten verklaren op celsignalering in het zenuwstelsel in de zenuwstel zenuwstelsel.
Geneesmiddelen geformuleerd tegen constipatie hebben kernen gestructureerd door fenylalanine, tyrosine en tryptofaan. Over het algemeen bevatten deze medicijnen mengsels van deze drie aminozuren in hun vormen-.
Deficiëntiestoornissen
Bloedfenylalaninespiegels zijn belangrijk om de goede werking van de hersenen te handhaven, omdat fenylalanine, tyrosine en tryptofaan de substraten zijn voor de assemblage van verschillende neurotransmitters.
Sommige aandoeningen relateren, eerder, met tekorten in het metabolisme van dit aminozuur, dat er een overmaat op genereert, in plaats van een tekort.
Fenylcetonurie, een ongewone erfelijke ziekte bij vrouwen, beïnvloedt de hepatische hydroxylering van fenylalanine en maakt de plasmaspiegels van dat aminozuur overdreven, zodat een neuronale apoptose wordt geïnduceerd en de normale ontwikkeling van de hersenen beïnvloedt.
Als een vrouw met fenylcetonurie zwanger wordt, kan de foetus presenteren wat bekend staat als het "hyperfenylalaninemie maternale" foetaal syndroom ".
Dit komt omdat de foetus hoge concentraties fenylalanine in het bloed heeft (bijna het dubbele van de normen), waarvan de oorsprong verband houdt met de afwezigheid van hepatische hydroxylase fenylalanine van de foetus, die zich pas in 26 weken van de zwangerschap ontwikkelt.
Foetaal syndroom door hyperfenylalaninemie Maternal, produceert foetale microcefalie, terugkerende abortussen, hartaandoeningen en zelfs niermalformaties.
Referenties
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, e., Bottiglieri, l.,… & Micu, r. (2018). Detectie en opruiming van hydroxylradicaal via d-fenylalanine-hydroxylering bij menselijke vloeistoffen. Talanta, 181, 172-181
- Cho, m. H., Korea, o. R., Yang, h., Bedgar, D. L., Laskar, D. D., Anterola, a. M.,… & Kang, c. (2007). Fenylalanine biosynthese in Thaliaanse Arabidopsis Identificatie en karakteritie van argenaat dehydratas. Journal of Biological Chemistry, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, m. H. (2007). Tyrosine, fenylalanine en cathocholaminesynthese en functie in de hersenen. The Journal of Nutrition, 137 (6), 1539S-1547s.
- Hou, J., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., & Willner, ik. (2018). Gekatalyseerde en elektrokatalyseerde oxidatie van L-tyrosine en L-fenylalanine tot dopachrome door nanozymen. Nano Letters, 18 (6), 4015-4022.
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- Perkins, r., & Vaida, V. (2017). Fenylalanine verhoogt de membraanpermeabiliteit. Journal of the American Chemical Society, 139 (41), 14388-14391.
- Plimmer, r. H. NAAR. (1912). De chemische constitutie van de eiwitten (vol. 1). Longmans, groen.
- Tensley, g. (2018). Gezondheidslijn. Ontvangen op 5 september 2018, van www.Gezondheidslijn.com/voeding/fenylalanine
- Tohge, T., Watanabe, m., Hoefgen, r., & Fernie, aan. R. (2013). Shikimate en fenylalanine biosynthese in de groene afkomst. Frontiers in Plant Science, 4, 62.
- « Isoleucine -kenmerken, functies, biosynthese, voedsel
- Nationale frontkenmerken, doelstellingen, presidenten »

