Isoleucine -kenmerken, functies, biosynthese, voedsel
- 4065
- 367
- Glen Armstrong
De isoleucine (Ile, i) is een van de 22 aminozuren die in de natuur aanwezig zijn als onderdeel van eiwitten. Gezien het feit dat het menselijk lichaam, net als dat van sommige andere zoogdieren, het niet kan synthetiseren, is isoleucine een van de 9 essentiële aminozuren die moeten worden verkregen met het dieet.
Dit aminozuur werd voor het eerst geïsoleerd in 1903 door wetenschapper F. Ehrlich van de stikstofbestanddelen van bieten of bieten melasse. Vervolgens scheidde dezelfde auteur isoleucine van de ontledingsproducten van fibrine en andere eiwitten.
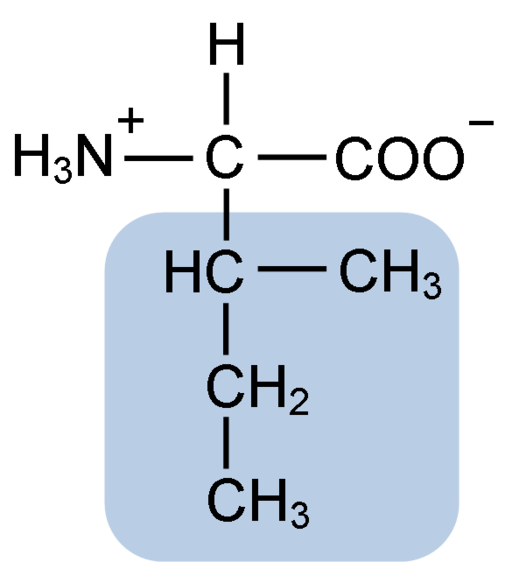
 Chemische structuur van het isoleucine-aminozuur (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Chemische structuur van het isoleucine-aminozuur (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Het is een niet -polair aminozuur aanwezig in veel van de celeiwitten van levende organismen, bovendien maakt het deel uit van de BCAAS -vertakte kettingaminozuren (van het Engels BGeroosterd CHaast NAARMijn nee NAARCids), Samen met Leucina en Valina.
Het heeft functies bij de oprichting van de tertiaire structuur van veel eiwitten en neemt bovendien deel aan de vorming van verschillende metabole voorlopers gerelateerd aan cellulaire energiemetabolisme.
[TOC]
Kenmerken
Isoleucine wordt geclassificeerd binnen de niet -polaire aminozuurgroep met groepen of ketens van aifatische aard, dat wil zeggen met koolwaterstofketens met koolwaterstoffen.
Vanwege dit kenmerk blijven de aminozuren van deze groep zoals alanine, Valina en Leucina de neiging dicht bij elkaar te blijven, wat bijdraagt aan de stabilisatie van eiwitten die deel uitmaken van hydrofobe interacties.
Dit niet -polaire aminozuur weegt ongeveer 131 g/mol en is aanwezig in eiwitten in een aandeel bijna 6%, vaak "begraven" in het midden ervan (dankzij de hydrofobe kwaliteiten).
Structuur
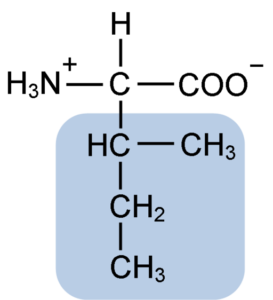
Isoleucine is een a-aminozuur dat, net als de andere aminozuren, een centraal koolstofatoom heeft genaamd α (dat chiraal is), waaraan vier verschillende groepen zijn samengevoegd: een atoom van waterstof, een aminogroep (-NH2), a Carboxylgroep (-coh) en een zijketen of r grupo.
De isoleucinegroep R bestaat uit een eenvoudige vertakte koolwaterstof van 4 koolstofatomen (-CH3-CH2-CH (CH3)) in wiens keten er is ook een quiral koolstofatoom.
Vanwege dit kenmerk heeft isoleucine vier mogelijke manieren: twee daarvan zijn de optische isomeren die bekend staan als L-isoleucine en D-isoleucine en de andere twee zijn diastereoisomeren van L-isoleucine. De overheersende vorm in eiwitten is L-isoleucine.
De moleculaire formule van isoleucine is C6H13NO2 en zijn chemische naam is a-amino-β-metyl-β-ethylpropionische of 2-amino-3-methyl pentatonzuur of zuurzuur of zuurzuur.
Functie
Isoleucine heeft meerdere fysiologische functies bij dieren, waaronder de
- Wond genezen
- Ontgifting van stikstofafval
- Stimulatie van immuunfuncties en
- Bevordering van secretie van verschillende hormonen.
Het wordt beschouwd als een glycogeen aminozuur, omdat het dient als een voorlopermolecuul voor de synthese van intermediairs van de citruszuurcyclus (Krebs -cyclus) die vervolgens bijdragen aan de vorming van glucose in de lever.
Om deze reden wordt aangenomen dat isoleucine deelneemt aan de regulering van plasmaglucosespiegels, wat belangrijke implicaties heeft vanuit het oogpunt van lichaamsenergie.
Isoleucine draagt bij aan de syntheseroutes van glutamine en alanine, die werkt voor de balans tussen vertakte ketenaminozuren.
In het klinische veld wijzen sommige auteurs erop dat een toename van concentraties van isoleucine, leucine, tyrosine en valine karakteristieke markers van tumor -aangetaste cellen kan zijn, gevolgd door een toename van glutaminespiegels.
Andere functies
Ander wetenschappelijk onderzoek heeft aangetoond dat isoleucine noodzakelijk is voor de synthese van hemoglobine, het eiwit dat verantwoordelijk is voor het transport van zuurstof in het bloed van veel dieren.
Bovendien activeert dit aminozuur de binnenkomst van voedingsstoffen in de cellen; Sommige studies laten zien dat het tijdens langdurig vasten in staat is om glucose te vervangen als een energiebron en bovendien is het een ketogeen aminozuur.
Het kan u van dienst zijn: biologie TijdlijnKetogene aminozuren zijn die wiens koolstofskeletten kunnen worden opgeslagen zoals vetzuren of koolhydraten, zodat ze in de energiereserve werken.
Isoleucine en andere vertakte ketenaminozuren (naast groeifactoren en omgevingscondities) werken aan de activering van de witte of doelsignaleringsroute van rapamycine, mTOR (van het Engels MTananistisch TArget ofF RApamycin)).
Deze route is een belangrijke signaalroute in eukaryoten die celgroei en metabolisme kunnen regelen, evenals eiwitsynthese en autofagie -gebeurtenissen. Bovendien regelt het de voortgang van veroudering en sommige pathologieën zoals kanker of diabetes.
Biosynthese
Mensen en andere dieren kunnen isoleucine niet synthetiseren, maar dit maakt deel uit van cel -eiwitten dankzij hun acquisitie van het voedsel dat we dagelijks consumeren.
Planten, schimmels en de meeste micro -organismen kunnen dit aminozuur synthetiseren vanuit enigszins complexe routes die meestal zijn verbonden met die van andere aminozuren die ook als essentieel worden beschouwd voor de mens.
Er zijn bijvoorbeeld manieren voor de productie van isoleucine, lysine, methionine en tronine uit het aspartaat.
In bacteriën wordt in het bijzonder isoleucine geproduceerd uit het treonine-aminozuur, door pyruvaat, via een route die de condensatie van 2 van de pyruvaat-koolstofatomen impliceert met een molecuul α-ecthobutiraat dat afkomstig is van de Treonine.
De reactie begint met de werking van het enzymdehydratase, dat de uitdroging van het tronine katalyseert om a-ecotobutiraat en ammonium (NH3) te produceren (NH3). Vervolgens dragen dezelfde enzymen die deelnemen aan de biosynthese van de valine bij aan de stappen van
- Transaminatie
- Oxidatieve decarboxylering van de overeenkomstige ketoacides en
- Dehydrogenering.
In dit type micro -organismen wordt de synthese van aminozuren zoals lysine, methionine, tronine en isoleucine zeer gecoördineerd en gereguleerd, vooral door negatieve feedback, waar reactiesproducten de activiteit van de betrokken enzymen belemmeren.
Hoewel isoleucine, zoals leucine en valine, essentiële aminozuren zijn voor de mens, kunnen Aminotransferae-enzymen die aanwezig zijn in lichaamsweefsels ze omkeerbaar converteren naar hun overeenkomstige α-ZO-stoten, die ze uiteindelijk in het dieet kunnen vervangen.
Degradatie
Als een groot deel van de aminozuren die in de natuur bekend zijn, kan isoleucine worden afgebroken om tussenpersonen van verschillende metabole routes te vormen, waaronder de Krebs -cyclus (die de grootste hoeveelheid co -enzymen biedt die werkt voor energieproductie of voor biosynthese van andere verbindingen )).
Zowel isoleucine als tryptofaan, lysine, fenylalanine, tyrosine, Treonine en leucine kunnen worden gebruikt om acetyl-CoA te produceren, een belangrijke metabole intermediair voor meerdere celreacties.
In tegenstelling tot andere aminozuren worden vertakte kettingaminozuren (leucine, isoleucine en valine) niet afgebroken in de lever, maar worden ze geoxideerd als brandstoffen in de spier, hersenen, nieren en vetweefsel.
Deze organen en weefsels kunnen deze aminozuren gebruiken dankzij de aanwezigheid van een aminotransferase-enzym dat in staat is om op de drie te werken en hun overeenkomstige aminozuur a-zo te produceren.
Zodra deze geoxideerde aminozuurderivaten zijn geproduceerd, katalyseert het a-zo-ketoacid-enzymatische enzymatische complex de oxidatieve decarboxylering ervan, waarbij het een kooldioxidemolecuul (CO2) vrijgeeft en een acyl-coa-derivaat van aminozuren in vraag brengt.
Pathologieën gerelateerd aan het metabolisme van isoleucine
Defecten in het metabolisme van isoleucine en andere aminozuren kunnen diversiteit van vreemde en complexe pathologieën zoals de ziekte veroorzaken ""Ahornsiroop urine”(Urine met arce siroop) of vertakte keten ketoaciduria.
Zoals de naam al aangeeft, wordt deze ziekte gekenmerkt door het onderscheidende aroma van de urine van patiënten die er last van hebben, naast braken, epileptische aanvallen, mentale retardatie en voortijdige dood.
Het moet specifiek doen met fouten in het a-cethoacid dehydrogenase-enzymatisch complex, zodat vertakte ketenaminozuren zoals isoleucine en zijn geoxideerde derivaten in de urine worden uitgescheiden in de urine.
Kan u van dienst zijn: Tafonomy: geschiedenis, behoud en fossiele veranderingSamen staan pathologieën gerelateerd aan het katabolisme van vertakte ketenaminozuren zoals isoleucine bekend als organische acidurias, hoewel die direct gerelateerd zijn aan dit aminozuur.
Voedsel rijk aan isoleucine
Dit aminozuur is overvloedig aanwezig in de spierweefsels van dieren, zodat vlees van dierlijke oorsprong zoals koe, varkensvlees, vis en andere soortgelijke zoals lam, kip, kalkoen, herten, ze zijn rijk aan hetzelfde.
Het wordt ook gevonden in de zuivelproducten en zijn derivaten zoals kaas. Het is in eieren en ook in verschillende soorten zaden en noten, als een essentieel onderdeel van de eiwitten die ze vormen.
Het is overvloedig in sojabonen en ertwintjes, evenals in de uittreksels van gisten die worden gebruikt met verschillende voedseldoeleinden.
De plasmaspiegels van isoleucine voor een volwassen mens zijn tussen 30 en 108 μmol/L, voor kinderen en jongeren tussen de 2 en 18 jaar oud zijn tussen 22 en 107 μmol/L en voor zuigelingen tussen 0 en 2 jaar tussen 26 jaar en 86 μmol/l.
Deze gegevens suggereren dat de consumptie van rijke voedingsmiddelen in deze en andere gerelateerde aminozuren noodzakelijk is voor het handhaven van veel van de fysiologische functies van het organisme, omdat mensen het niet kunnen synthetiseren van novo.
Voordelen van uw inname
Voedingssupplementen met isoleucine bevatten meestal andere essentiële aminozuren van vertakte ketting, zoals valine of leucine of andere.
Een van de meest voorkomende voorbeelden van isoleucineconsumptie zijn de voedingssupplementen die door atleten worden gebruikt om het percentage spiermassa of eiwitsynthese te verhogen. De wetenschappelijke basis waarop deze praktijken worden ondersteund, worden echter voortdurend besproken en hun resultaten zijn niet volledig gegarandeerd.
Isoleucine wordt echter gebruikt om de metabole effecten van vitaminedeficiëntie (pelagra) kenmerken van patiënten die rijke sorghum- en maïdiëten hebben, tegen te gaan, die voedingsmiddelen zijn met een hoog leucinegehalte, die het metabolisme van de tryptofaan en nicotinezuur bij mensen kunnen beïnvloeden bij mensen.
De effecten van pelagra op experimentele ratten omvatten bijvoorbeeld groeivertragingen, die worden overwonnen met isoleucinesuppletie.
- In de dierproductie -industrie
Op het gebied van dierproductie zijn aminozuren zoals lysine, tronine, methionine en isoleucine gebruikt in piloottests voor het voeding van de varkensvoeding in gecontroleerde omstandigheden.
Isoleucine lijkt met name effecten te hebben op stikstofassimilatie, hoewel het niet bijdraagt aan de gewichtstoename van deze boerderijdieren.
- In sommige klinische omstandigheden
Sommige publicaties suggereren dat isoleucine in staat is om plasmaglucosespiegels te verlagen, dus hun inname wordt aanbevolen bij patiënten met aandoeningen zoals diabetes of lage insulineproductiesnelheid.
Virale infecties
ISOLEUEUCINE -suppletie is nuttig gebleken bij patiënten die zijn geïnfecteerd met rotavirus die ziekten veroorzaken zoals gastro -enteritis en diarree bij jonge kinderen en andere jonge dieren.
Recente studies concluderen dat de consumptie van dit aminozuur door experimentele dieren met de bovengenoemde kenmerken (geïnfecteerd met rotavirus) helpt bij de groei en prestaties van het aangeboren immuunsysteem dankzij de activering van PRR -signaalroutes of receptoren met herkenning van herkenning van herkenning van herkenning van herkenning van herkenning van herkenning van Patronen.
Deficiëntiestoornissen
Geficiëntie isoleucine kan problemen dragen in het gezichtsvermogen, huid (zoals dermatitis) en darmen (duidelijk als diarree en andere gastro -intestinale manifestaties))).
Gezien het feit dat het een essentieel aminozuur is voor de vorming en synthese van hemoglobine, evenals voor de regeneratie van erytrocyten (bloedcellen), kunnen ernstige tekortkomingen in isoleucine ernstige fysiologische gevolgen hebben, met name gerelateerd aan bloedarmoede en andere hematologische ziekten.
Kan u van dienst zijn: tertiaire consumentenDit is experimenteel aangetoond in "normale" knaagdieren waaraan slechte diëten zijn verstrekt in deze isoleucine, die eindigt met de ontwikkeling van belangrijke anemische schilderijen.
Isoleucine neemt echter alleen aan de vorming van hemoglobine deel bij zuigelingen, omdat het eiwit van de volwassen mens geen belangrijke hoeveelheden van dergelijk aminozuur heeft; Dit betekent dat het gebrek aan isoleucine duidelijker is tijdens de eerste stadia van de ontwikkeling.
Referenties
- Aders Plimmer, r. (1908). De chemische samenstelling van de eiwitten. Ik ben weggegaan. Londen, VK: Longmans, Green en Co.
- Aders Plimmer, r. (1908). De chemische samenstelling van de eiwitten. Deel II. Londen, VK: Longmans, Green en Co.
- Barret, g., & Elmore, D. (2004). Aminozuren en peptiden. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, K. (1996). Artsengids voor de laboratoriumdiagnose van metabole ziekten (2e ed.)).
- Bradford, h. (1931). De geschiedenis van de ontdekking van de aminozuren. II. Een overzicht van aminozuren die sinds 1931 worden beschreven als componenten van natieve eiwitten. Vooruitgang in eiwitchemie, 81-171.
- Campos-Ferraz, P. L., Bozza, T., Nicastro, h., & Boot, naar. H. (2013). Duidelijke effecten van leucine of een mengsel van de vertakte keten amininozuur (leucine, isoleucine en valine) suppletie op resistentie tegen vermoeidheid, spier- en lever-glycogeenafbraak, bij getrainde rattenratten, ratten. Voeding, 29(11-12), 1388-1394.
- Champe, p., & Harvey, r. (2003). Aminozuren aminozuren. In Lippincott's Illustrated Reviews: Biochemistry (3e ed., PP. 1-12). Lippincott.
- Chandran, K., & Damodaran, m. (1951). Aminozuur en eiwitten in hemoglobinevorming 2. Isoleucine. Journal Biochemical, 49, 393-398.
- Chung, een. S., & Beames, r. M. (1974). Lysine, threonine, methionine en isoleucinesuppletie van Peace River Barley voor het kweken van varkens. Hond. J. Animeren. Sci., 436, 429-436.
- Dejong, c., Meijerink, W., Van Berlo, C., Deutz, n., & Soeters, p. (1996). Afgeschakelde plasma -isoleucine concentratoren na bovenste gastroogtoele bloeding bij mensen. DARM, 39, 13-17.
- Edsall, J. (1960). Amininozuren, eiwitten en kanker biochemie (Vol. 241). Londen: Academic Press, Inc.
- Britannica Encyclopaedia. (2012). Ontvangen 30 augustus 2019, van https: // www.Britannica.com/science/isoleucine
- Gelfand, r., Hendler, r., & Sherwin, r. (1979). Koolhydraat en metabolisme van het voedingsmiddel van ingenomen eiwitten. Het Lancet, 65-68.
- Hudson, B. (1992). Biochemie van voedselproteïnen. Springer-Science+Business Media, B.V.
- Knerr, ik., Vockley, J., & Gibson, K. M. (2014). Stoornissen van leucine, isoleucine en valine metabolisme. Cafe. Blau (Ed.)), Artsengids voor de diagnose, behandeling en follow-up van erfelijke metabole ziekten (PP. 103-141).
- Korman, s. H. (2006). Aangeboren fouten van afbraak van isoleucine: een overzicht. Moleculaire genetica en metabolisme, 89(4), 289-299.
- Krishnaswamy, K., & Gpalan, c. (1971). Effect van isoleucine op huid en elektro -encefalogram in pellagra. Het Lancet, 1167-1169.
- Martin, r. EN., & Kirk, K. (2007). Transport van de esentiële isoleucine van voedingsstoffen in menselijke erytrocyten geïnfecteerd met de malaria parasiet Plasmodium falciparum. Bloed, 109(5), 2217-2224.
- Nationaal centrum voor biotechnologie -informatie. PubChem -database. L-isoleucine, CID = 6306, https: // pubchem.NCBI.NLM.NIH.GOV/COMPUND/L-isoleucine (bezocht op augustus. 31, 2019)
- Nuttall, f. Q., Schweim, K., & Gannon, m. C. (2008). Effect van oraal toegediend isoleucine met en zonder glucose op insuline-, glucagon- en glucoseconcentraties bij niet-diabetische onderwerpen. Het Europese e-journal van klinische voeding en metabolisme, 3(4), 152-158.
- Van Berlo, C. L. H., Van de bogaard. EN. J. M., Van der heijden, m. NAAR. H., Van Eijk, h. M. H., Janssen, m. NAAR., Bost, m. C. F., & Soeters, p. B. (1989). Is ongelooflijke ammoniakbevrijding na bloedingen in het spijsverteringskanaal? Een studie bij varkens. Hepatologie, 10(3), 315-323.
- Vickery, h. B., & Schmidt, c. L. NAAR. (1931). De geschiedenis van de ontdekking van de aminozuren. Chemische beoordelingen, 9(2), 169-318.
- Wolfe, r. R. (2017). Vertakte keten amins en spiereiwitsynthese bij mensen: mythe of realiteit? Journal of the International Society of Sports Nutrition, 14(1), 1-7.
- Wu, g. (2009). Amininozuren: metabolisme, functies en voeding. Amininozuren, 37(1), 1-17.
- « Industriële ecologiegeschiedenis, doelstellingen, voorbeelden
- Fenylalanine -kenmerken, functies, biosynthese, voedsel »

