Rutherford Experiment History, Beschrijving en conclusies
- 4063
- 1244
- Dewey Powlowski
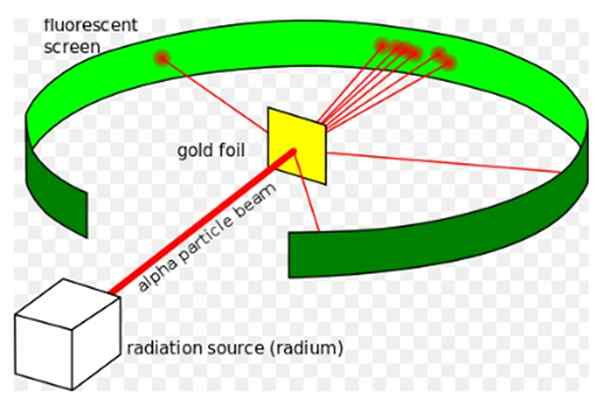
Hij Rutherford Experiment, Tussen 1908 en 1913 bestond het uit het bombarderen van een dun gouden vel van 0.0004 mm dik, met alfa -deeltjes en analyseer het dispersiepatroon dat deze deeltjes op een fluorescerend scherm achterlieten.
Eigenlijk heeft Rutherford talloze experimenten uitgevoerd, waardoor de details steeds meer worden verfijnd. Na zorgvuldig de resultaten te hebben geanalyseerd, werden twee zeer belangrijke conclusies onthuld:
-De positieve belasting van het atoom is geconcentreerd in een genaamd gebied kern.
-Deze atoomkern is ongelooflijk klein in vergelijking met de grootte van de atoom.
 Figuur 1. Rutherford's experiment. Bron: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Figuur 1. Rutherford's experiment. Bron: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Ernest Rutherford (1871-1937) was een natuurkundige geboren in Nieuw-Zeeland, wiens belangenveld radioactiviteit en aard van materie was. Radioactiviteit was een recent fenomeen toen Rutherford zijn experimenten begon, het was ontdekt door Henri Becquerel in 1896.
In 1907 verhuisde Rutherford naar de Universiteit van Manchester in Engeland om de structuur van het atoom te bestuderen, met behulp van deze alfa -deeltjes als sondes om het interieur van zo'n kleine structuur te onderzoeken. Natuurkundigen Hans Geiger en Ernest Marsden vergezelden hem in de taak.
Ze huisden de hoop om te zien hoe een alfa -deeltje, een dubbel geïoniseerd heliumatoom, interactie had met een uniek gouden atoom, om ervoor te zorgen dat elke afwijking die het ervoer alleen te wijten was aan de elektrische kracht.
De meeste alfa -deeltjes staken echter het gouden plaat over en liepen echter op slechts een kleine afwijking.
Dit feit was het in totaal in overeenstemming met het atoommodel van Thomson, maar tot de verrassing van de onderzoekers had een klein percentage van de alfa -deeltjes een vrij opmerkelijke afwijking.

En een nog kleiner percentage deeltjes keerde terug, volledig achteruit stuiterend. Waarom waren deze onverwachte resultaten?
[TOC]
Beschrijving en conclusies van het experiment
In feite zijn de alfa -deeltjes die Rutherford als sonde gebruikte, heliumkernen, en op dat moment was het alleen bekend dat deze deeltjes positieve lading hadden. Tegenwoordig is het bekend dat alfa -deeltjes zijn samengesteld uit twee protonen en twee neutronen.
Alfa- en bèta -deeltjes waren door Rutherford geïdentificeerd als twee verschillende soorten straling van uranium. Alpha -deeltjes, veel massiever dan het elektron, hebben een positieve elektrische lading, terwijl bèta -deeltjes elektronen of positronen kunnen zijn.
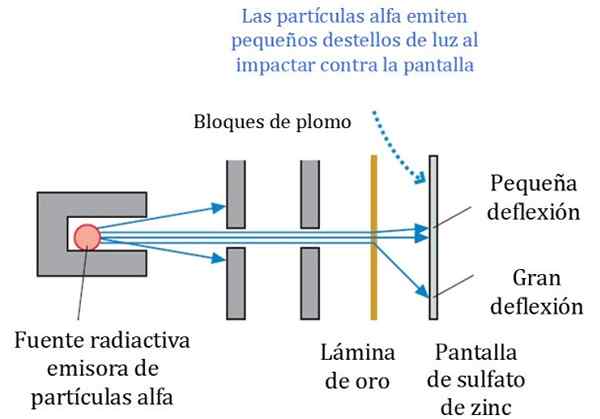 Figuur 2. Gedetailleerd schema van het experiment Rutherford, Geiger en Marsden. Bron: r. Ridder. Fysica voor wetenschappers en engineering: een strategiebenadering. Pearson.
Figuur 2. Gedetailleerd schema van het experiment Rutherford, Geiger en Marsden. Bron: r. Ridder. Fysica voor wetenschappers en engineering: een strategiebenadering. Pearson. Figuur 2 toont een vereenvoudigd schema van het experiment. De alfa -deeltjesstraal komt uit een radioactieve bron. Geiger en Marsden gebruikten radongas als emitter.
Loodblokken werden gebruikt om de straling naar het gouden plaat te sturen en te voorkomen dat ze rechtstreeks naar het fluorescerende scherm stoppen. Lood is een materiaal dat straling absorbeert.
Kan u van dienst zijn: centrioles: functies en kenmerkenVervolgens werd de gerichte straal dus beïnvloed op een dunne gouden plaat en de meeste deeltjes volgen hun weg naar het fluorescerende zinksulfaatscherm, waar ze een kleine lichte voetafdruk achterlieten. Geiger had de leiding over het één voor één te tellen, hoewel ze vervolgens een apparaat hebben ontworpen dat het deed.
Het feit dat sommige deeltjes een kleine afbuiging ervoeren, verbaasde Rutherford, Geiger en Marsden niet. In het atoom zijn er immers positieve en negatieve ladingen die sterkte uitoefenen op alfa -deeltjes, maar omdat het atoom neutraal is, waarvan ze al wisten, zouden de afwijkingen klein moeten zijn.
De verrassing van het experiment is dat een paar positieve deeltjes bijna direct werden gestuiterd.
Conclusies
Ongeveer 1 op de 8000 alfa -deeltjes ervoeren afbuiging bij hoeken groter dan 90º. Weinigen, maar genoeg om enkele dingen in vraag te stellen.
Het atoommodel in Boga was dat van Thomson's pudin, voormalig professor Rutherford aan het Cavendish Laboratory, maar hij vroeg zich af of het idee van een atoom zonder kern en met de elektronen ingebed als rozijnen, het was correct.
Omdat het blijkt dat deze grote afbuiging van de alfa -deeltjes en het feit dat enkelen kunnen terugkeren, kan het alleen worden uitgelegd als een atoom een kleine, zware en positieve kern heeft. Rutherford ging ervan uit dat alleen de krachten van elektrische aantrekkingskracht en afstoting, zoals aangegeven door de wet van de Coulomb, verantwoordelijk waren voor elke afwijking.
Wanneer sommige van de alfa -deeltjes direct de kern naderen en omdat de elektrische kracht varieert met het omgekeerde vierkant van de afstand, voelen ze een afstoting die hen de dispersie van grote hoek of de afwijking achteruit veroorzaakt.
Om ervoor te zorgen dat Geiger en Marsden bombardementen van verschillende metalen ervaren, niet alleen goud, hoewel dit metaal het meest geschikt was voor hun kneedbaarheid, om zeer fijne vellen te maken.
Bij het behalen van vergelijkbare resultaten overtuigde Rutherford ervan dat de positieve lading in het atoom zich in de kern zou moeten bevinden, en niet in zijn gehele volume verspreid, zoals Thomson in zijn model postuleerde.
Aan de andere kant, net als de overgrote meerderheid van de alfa -deeltjes, gebeurde het zonder af te wijken, de kern zou heel, heel klein moeten zijn in vergelijking met de atoomgrootte. Deze kern moest zich echter het grootste deel van de massa van het atoom concentreren.
Invloeden in het atoommodel
De resultaten waren zeer verrast bij Rutherford, die tijdens een conferentie in Cambridge verklaarde: “... het is alsof je een 15 -inch kanonskogel schiet tegen een vel zijden papier en het projectiel stuitert rechtstreeks naar je toe en raakt je".
Kan u van dienst zijn: 10 functies van het theoretische kader van een onderzoekOmdat deze resultaten niet konden worden verklaard door het atoommodel van Thomson, stelde Rutherford voor dat het atoom was gevormd door een kern, zeer klein, zeer massief en positief geladen. De elektronen bleven over om banen om hen heen te beschrijven, welk miniatuursysteem op zonne -energie.
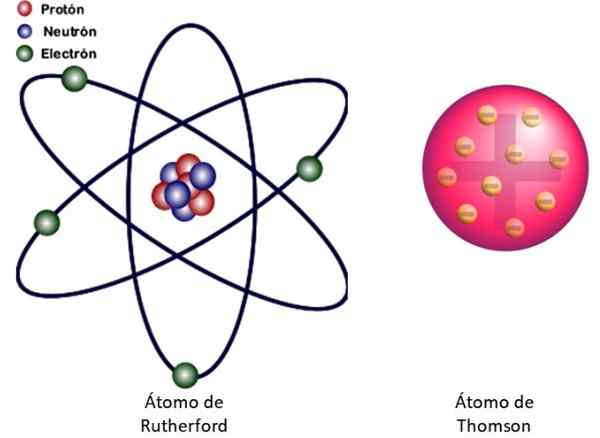 figuur 3. Links het atoommodel van Rutherford en rechts het Buddin -type model van Thomson's. Bron: Wikimedia Commons. Linksafbeelding: JCYMC90 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
figuur 3. Links het atoommodel van Rutherford en rechts het Buddin -type model van Thomson's. Bron: Wikimedia Commons. Linksafbeelding: JCYMC90 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Dit is het nucleaire model van het atoom getoond in figuur 3 naar links. Omdat elektronen ook heel, heel klein zijn, blijkt dat het atoom bijna alles is .. . leeg! Daarom kruist de meeste alfa -deeltjes het vel zonder alleen af te wijken.
En de analogie met een miniatuur zonnestelsel is zeer succesvol. De atomaire kern speelt de rol van de zon en bevat bijna de hele massa plus de positieve belasting. De elektronen draaien om hen heen zoals de planeten en dragen de negatieve belasting. De set is elektrisch neutraal.
Over de verdeling van elektronen in het atoom, het experiment van Rutherford toonde niets aan. Men zou kunnen worden gedacht dat alfa -deeltjes er enige interactie mee zouden hebben, maar de massa elektronen is te klein en konden de deeltjes niet aanzienlijk afleiden.
Nadelen in het Rutherford -model
Een probleem met dit atoommodel was precies het gedrag van elektronen.
Als deze niet statisch waren, maar om de atoomkern in circulaire of elliptische banen in een baan te laten gaan, gericht door de elektrische aantrekkingskracht, zouden ze uiteindelijk naar de kern haasten.
Dit komt omdat versnelde elektronen energie verliezen, en als dat gebeurt, zou dit de ineenstorting van het atoom en materie zijn.
Gelukkig is dit niet wat er gebeurt. Er is een soort dynamische stabiliteit die instorting vermijdt. Het volgende atoommodel, na dat van Rutherford, was dat van Bohr, die enkele antwoorden gaf op waarom de atomaire ineenstorting niet optreedt.
Het proton en neutron
Rutherford bleef dispersie -experimenten doen. Tussen 1917 en 1918 kozen hij en zijn assistent William Kay om te bombarderen.
Het was opnieuw verrast bij het detecteren van waterstofkernen. Dit is de reactievergelijking, de eerste kunstmatige nucleaire transmutatie heeft nooit bereikt:
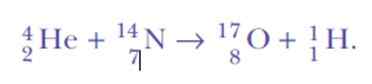 Welnu, als alfa -deeltjes heliumkernen zijn, waar kunnen waterstofkernen vandaan komen?
Welnu, als alfa -deeltjes heliumkernen zijn, waar kunnen waterstofkernen vandaan komen?
Het antwoord was: van dezelfde stikstof. Rutherford had toegewezen aan waterstofatoomnummer 1, omdat het het eenvoudigste element van allemaal was: een positieve kern en een negatief elektron.
Rutherford had een fundamenteel deeltje gevonden dat hij noemde proton, een naam afgeleid van het Griekse woord tot Eerst. Op deze manier is het proton een essentieel bestanddeel van elke atoomkern.
Kan u van dienst zijn: volumeLater, in 1920, stelde Rutherford voor dat er een neutraal deeltje zou moeten zijn en met een massa erg vergelijkbaar met die van het proton. Hij noemde dit deeltje neutron en maakt deel uit van bijna alle bekende atomen. Natuurkundige James Chadwick identificeerde het eindelijk in 1932.
Hoe is een schaalmodel van het waterstofatoom?
Het waterstofatoom is, zoals we hebben gezegd, de eenvoudigste van allemaal. Het was echter niet eenvoudig om een model voor dit atoom uit te werken.
Opeenvolgende ontdekkingen gaven aanleiding tot kwantumfysica en een hele theorie die het fenomenen op atoomniveau beschrijft. Tijdens dit proces evolueerde het atoommodel ook. Maar laten we de kwestie van de maten een beetje bekijken:
Het waterstofatoom heeft een kern bestaande uit een proton (positief) en heeft een enkel elektron (negatief).
De straal van het waterstofatoom is geschat op 2.1 x 10-10 m, terwijl het proton 0 is.85 x 10 -vijftien M of 0.85 femtometers. De naam van deze kleine eenheid is te wijten aan Enrico Fermi en wordt veel gebruikt bij het werken aan deze schaal.
Welnu, het quotiënt tussen de straal van het atoom en dat van de kern is in de orde van 105 M, dat wil zeggen, het atoom is 100.000 keer groter dan de kern!.
We moeten er echter rekening mee houden dat in het hedendaagse model, gebaseerd op kwantummechanica, het elektron de kern omvat in een soort wolk die wordt genoemd orbitaal (een baan is geen baan) en het elektron, op een atomaire schaal, is niet punctueel.
Als het waterstofatoom breed wordt verbreed - tot de grootte van een voetbalveld, dan zou de kern bestaande uit een positief proton de grootte van een mier in het midden van het veld zijn, terwijl het negatieve elektron als een soort geest zou zijn, verspreid over het veld en omringen van de positieve kern.
Het atoommodel vandaag
Dit "planetaire" atoommodel is erg geworteld en is het beeld dat de meeste mensen van het atoom hebben, omdat het heel gemakkelijk is om te visualiseren. Echter, het is niet Het model dat vandaag is geaccepteerd op wetenschappelijk gebied.
Hedendaagse atoommodellen zijn gebaseerd op kwantummechanica. Ze wijst erop dat het elektron in het atoom geen zin heeft met negatieve belasting die volgt op precieze banen, zoals die van Rutherford.
Integendeel, het elektron is verspreid In gebieden, rond de positieve kern, genoemd atomaire orbitalen. Van hem kunnen we het weten waarschijnlijkheid om elkaar in een of andere staat te ontmoeten.
Desondanks betekende het Rutherford -model een enorme vooruitgang in de kennis van de innerlijke structuur van het atoom. En ze vielen de weg over voor meer onderzoekers om het te blijven perfectioneren.
Referenties
- Andriessen, m. 2001. HSC -cursus. Natuurkunde 2. Jacaranda HSC Science.
- Arfken, G. 1984. Universiteitsfysica. Academische pers.
- Ridder, r. 2017. Fysica voor wetenschappers en engineering: een strategiebenadering. Pearson.
- Fysica openlab. Het experiment Rutherford-Geiger-Marsden. Hersteld van: PhysicsOpenLab.borg.
- Rex, a. 2011. Fundamentals of Physics. Pearson.
- Tyson, T. 2013. Het Rutherford Scattering Experiment. Hersteld van: 122.Natuurkunde.Ucdavis.Edu.
- Xaktly. Rutherford's experimenten. Hersteld van: xaktly.com.
- Wikipedia. Rutherford Experiment. Hersteld van: het is.Wikipedia.borg.
- « Autotrofe voedingskenmerken, fasen, typen, voorbeelden
- Anna Freud Biography, theorieën, verdedigingsmechanismen, werken »

