Kristallijne structuur
- 2587
- 122
- Lonnie Rohan
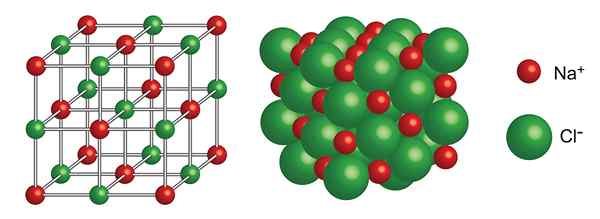
 Kristallijne structuur van natriumchloride
Kristallijne structuur van natriumchloride Wat is de kristallijne structuur?
De kristallijne structuur Het verwijst naar de manier waarop atomen, ionen of moleculen zijn georganiseerd of verpakt in kristallijne vaste stoffen zoals diamanten, zout (natriumchloride) of suiker (sucrose).
Kristallijne vaste stoffen worden gevormd drie -dimensionale netwerken van identieke eenheden genaamd Unit Cellen. Deze lijken op kleine identieke constructieblokken (zoals layo's) die aan elkaar binden om de kristallen te vormen die we met het blote oog kunnen zien.
De kristallijne structuur bestaat uit een beschrijving van de vorm van deze unitaire cel en de exacte positie die elk atoom heeft in genoemde cel.
Kenmerken van de kristallijne structuur
Worden gevormd door eenheidscellen die worden herhaald
De kristallijne structuur bestaat uit de herhaling van een eenheidscel in alle richtingen. Deze cellen bestaan uit drie -dimensionale parallellepipeds waarvan de vorm en grootte worden gedefinieerd door drie vectoren die worden genoemd A, B En C, en door de hoeken tussen deze vectoren, α, β en γ genoemd.
Het zijn zeer geordende structuren
De kristallijne structuur wordt gekenmerkt door een van de meest geordende staten die bestaan. De kristallen zijn zo geordend dat met het kennen van de structuur van de eenheidscel die slechts een handvol atomen bevat, de gehele structuur van een glas gevormd door miljoenen atomen, ionen of moleculen kan worden herbouwd.
Ze presenteren symmetrie
De meeste eenheidscellen waarmee kristallijne vaste stoffen kunnen worden gebouwd, hebben een soort symmetrie. Dit betekent dat de inhoud van een deel van de cel in een ander deel ervan wordt herhaald na het uitvoeren van een rotatie, reflectie of investering.
Kan u van dienst zijn: roterende droger: bediening, waarvoor is het voor, onderdelen, toepassingenAls een eenheidscel bijvoorbeeld een symmetrievlak heeft, betekent dit dat de ene helft van de cel de weerspiegeling van de andere is.
Relatie tussen eigenschappen van materie en kristallijne structuur
Er zijn veel fysische en chemische eigenschappen die afhankelijk zijn van de kristallijne structuur:
Dikte
Afhankelijk van de manier waarop atomen worden verpakt in de kristallijne structuur, kunnen compacte structuren of structuren worden verkregen waarin atomen verder van elkaar zijn. In het eerste geval zal een dichte en zware vaste stof worden verkregen, omdat meer atomen in een lager volume zijn verpakt.
-
Voorbeeld
Als we de drie kubieke kristallijne structuren vergelijken die eenvoudige kubieke (P), kubiek gecentreerd op gezichten (FCC) en kubiek gecentreerd op het lichaam (BCC) vergelijken voor gelijke atomen, is de BCC -structuur 2.6 keer dichter dan de FCC, en de FCC is 1.4 keer dichter dan P.
Kristallijne vorm
De vorm van de kristallen die we met het blote oog kunnen zien, is een weerspiegeling van de kristallijne structuur, en in het bijzonder van de unitaire cel. Afhankelijk van de structuur van de unitaire cel, zullen de kristallen meer in de ene richting groeien dan in andere, wat aanleiding geeft tot kristallen met verschillende vormen zoals naalden, quota, zeshoekige kristallen, enz.
Anisotropie
Fysische eigenschappen zoals thermische of elektrische geleidbaarheid en de magnetische eigenschappen van materie zijn vaak groter in een materiaalrichting dan in een andere.
Dit wordt anisotropie genoemd, en deze effecten zijn bijzonder intens in kristallijne structuren omdat ze zeer geordend zijn en regelmatig structuren.
Kan u van dienst zijn: diastreomerenSoorten kristallijne structuur
Kristallijne structuren kunnen worden geclassificeerd volgens het type eenheidscel waarmee ze worden gevormd. Deze worden gekenmerkt door de drie zijden die verbinding maken met een van de randen (A, B en C genoemd) en door de hoeken tussen deze zijden (α, β en γ genoemd).
Dit geeft aanleiding tot 7 kristallijne systemen. Binnen elk van deze kristallijne systemen kunnen verschillende soorten eenheidscellen worden onderscheiden. In totaal zijn er 14 verschillende eenheidscellen die de 14 Bravais -netwerken worden genoemd en hieronder worden weergegeven:
Kubisch systeem
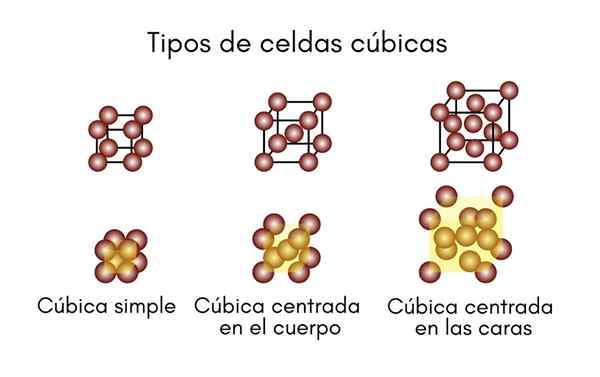
Zoals de naam al aangeeft, bestaat de eenheidscel uit een perfecte kubus. De drie zijden, A, B en C zijn gelijk aan elkaar en hun drie hoeken zijn allemaal 90 °. Dit systeem bestaat uit cellen:
- Eenvoudig of primitief kubiek.
- Kubiek gecentreerd in het lichaam (BCC).
- Kubiek gecentreerd op gezichten (FCC).
Tetragonaal systeem
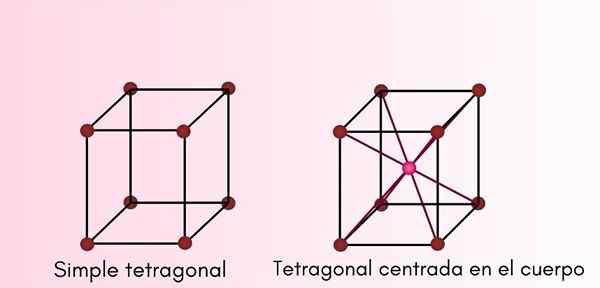
In dit type kristallijne structuur zijn A en B hetzelfde, maar C is anders, maar blijven allemaal loodrecht op elkaar. Tetragonale cellen kunnen zijn:
- Eenvoudig of primitief tetragonaal.
- Body gecentreerd tetragonaal.
Ortorrombisch systeem
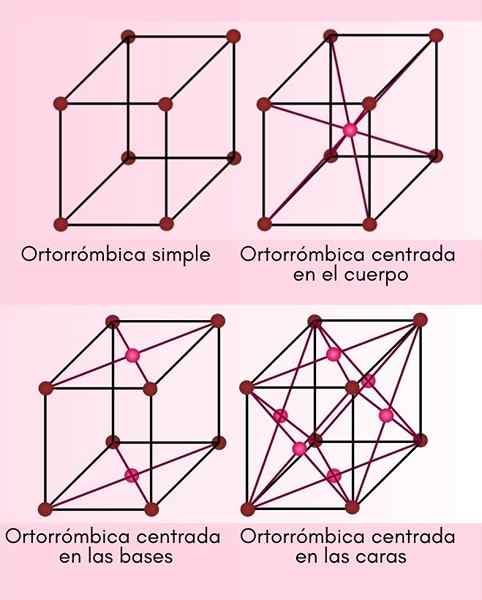
In dit kristallijne systeem zijn A, B en C allemaal verschillend, maar ze staan nog steeds loodrecht op elkaar. Er zijn 4 verschillende ortorrombische cellen:
- Primitief of eenvoudig ortorrombisch.
- Body -gecentreerd orthroom.
- Basisgericht orthroom.
- Gezichtsgericht ortorombisch.
Monoklinisch systeem
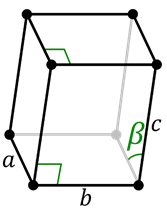 Primitieve monokliene cel
Primitieve monokliene cel 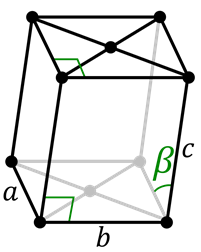 Base -gecentreerde monokliene cel
Base -gecentreerde monokliene cel Het monoklinische systeem is vergelijkbaar met zeshoekig, behalve het feit dat alle kanten anders zijn. Er zijn twee cellen voor het monoklinische systeem:
- Primitief monoklinisch.
- Basisgericht monoklinisch.
Triclinisch systeem
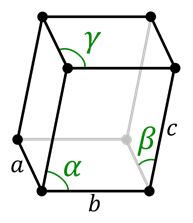 Triclinische cel
Triclinische cel In het driewielersysteem is er geen symmetrie. Alle hoeken verschillen van elkaar en hoeven niet noodzakelijk 90 ° te zijn. Al zijn kanten zijn ook anders.
Zeshoekig systeem
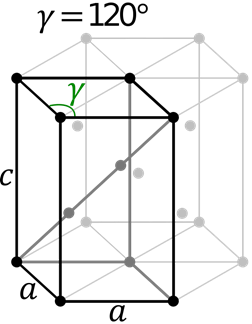 Zeshoekige cel
Zeshoekige cel Deze cel bevat zijden A en B verschillende en verschillende C -zijde. De hoeken α en β zijn beide 90 ° terwijl γ = 120 °.
Trigonaal of Rhomboyaans systeem
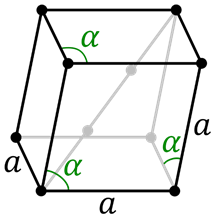 Trigonale of rhomboedische cel
Trigonale of rhomboedische cel Dit is een bepaald type structuur vergelijkbaar met het nemen van een emmer en het uitrekken langs twee tegenovergestelde hoekpunten. Alle partijen zijn hetzelfde en ook hun hoeken, maar deze zijn niet 90 °.
Voorbeelden van kristallijne structuren
Natriumchloride
De kristallijne structuur bestaat uit een kubisch netwerk gecentreerd op gezichten met 4 NaCl -eenheden voor elke eenheidscel,
Alfa Iron
IJzer kristalliseert alfa -ijzer bij 768 ° C. De structuur is kubisch gecentreerd in het lichaam met een 2 -edge van 2.86 Å (of 286 PM)
Gamma -ijzer
Het is een ijzervorm die optreedt tussen 910 ° C en 1400 ° C en een kubieke kristallijne structuur heeft gecentreerd op de gezichten van 3.64 Å (364 pm) rand.
Diamant
De diamant is een van de meest waardevolle koolstofvormen en heeft een kubieke kristallijne structuur gecentreerd op gezichten (FCC) die twee koolstofatomen en een 3 -rand van 3 bevat.75 Å (155 uur).
Grafiet
Grafiet is een andere veel voorkomende koolstof. In dit geval zijn dit vellen van koolstofatomen samen en vormen 6 -mijl ringen, wat aanleiding geeft tot een zeshoekige kristallijne structuur.

