Microscopische schaaleigenschappen, het tellen van deeltjes, voorbeelden
- 2849
- 503
- Cecil Graham
De Microscopische schaal Het is er een die wordt gebruikt om de maten en lengtes te meten die niet met het blote oog kunnen worden gezien en die onder de millimeter in lengte liggen. Van hoger naar laagste zijn de microscopische schalen in het metrische systeem:
- De millimeter (1 mm), de tiende van een centimeter of de duizendste van één meter. Hierin is het de schaal die we een van de grootste cellen in het lichaam hebben, de eicel, waarvan de grootte 1,5 mm is.
 Figuur 1. Rode bloedcellen zijn microscopische schaalcellen. Bron: Pixabay
Figuur 1. Rode bloedcellen zijn microscopische schaalcellen. Bron: Pixabay - De tiende van een millimeter (0,1 mm). Dit is de schaal van de dikte of diameter van menselijk haar.
- De micrometer of micra (1μm = 0,001 mm). Op deze schaal zijn planten- en diercellen en bacteriën.
Plantencellen zijn in de orde van 100 μm. Dierlijke cellen zijn tien keer klein, het is in de orde van 10 μm; Terwijl bacteriën 10 keer minder zijn dan dierlijke cellen en in de orde van 1 μm zijn.
[TOC]
Nanometrische schaal
Er zijn nog kleinere maatregelen dan de microscopische schaal, maar die meestal niet worden gebruikt, behalve in sommige speciale contexten. Vervolgens zullen we enkele van de belangrijkste nanometrische maatregelen zien:
- De nanometer (1 ηm = 0,001 μm = 0,000001 mm) is de miljoenste van een millimeter. Op deze schaal zijn enkele virussen en moleculen. De virussen zijn in de orde van de 10ηm en de moleculen in de orde van 1ηm.
- De angstrom (1Å = 0,1ηm = 0,0001μm = 10-7mm). Deze maat vormt de atomaire schaal of grootte.
- De Fantometer (1FM = 0.00001Å = 0.000001ηm = 10-12mm). Dit is de schaal van de atoomkernen, die tussen de 10 duizend en 100 duizend keer kleiner zijn dan de atoom. Ondanks zijn kleine omvang concentreert de kern echter 99,99% van de atoommassa.
- Er zijn schalen kleiner op de atoomkern, omdat deze bestaan uit deeltjes zoals protonen en neutronen. Maar er zijn meer: deze deeltjes worden op hun beurt gevormd door meer fundamentele deeltjes zoals quarks.
Instrumenten voor microscopische observatie
Wanneer de objecten zich tussen de millimeter en micrometrische schaal (1 mm - 0,001 mm) bevinden, kunnen ze worden waargenomen met een optische microscoop.
Als de objecten of structuren zich echter tussen de nanometers en de angstrom bevinden, zijn elektronische of nanoscoopmicroscopen vereist.
In elektronische microscopie worden in plaats van lichte elektronen met hoge energie gebruikt die een veel lagere golflengte hebben dan licht. Het nadeel van de elektronische microscoop is dat het niet mogelijk is.
Kan u van dienst zijn: magnetische schok: eenheden, formules, berekening, voorbeeldenAan de andere kant wordt het laserlicht gebruikt in de nanoscoop, en het heeft het voordeel ten opzichte van elektronische microscopie dat de structuren en moleculen kunnen worden bekeken en opgenomen in een levende cel.
Nanotechnologie is de technologie waarmee circuits, structuren, onderdelen en zelfs motoren worden vervaardigd op de schalen variërend van de nanometer tot de atoomschaal.
Microscopische eigenschappen
In de natuurkunde, in een eerste benadering, worden het gedrag van materie en systemen bestudeerd vanuit het macroscopische oogpunt. Uit dit paradigma is de zaak een oneindig deelbaar continuüm; En dit gezichtspunt is geldig en voldoende voor veel situaties van het dagelijkse leven.
Sommige fenomenen van de macroscopische wereld hebben echter alleen uitleg als de microscopische eigenschappen van de zaak in aanmerking worden genomen.
In het microscopische oogpunt wordt rekening gehouden met de moleculaire en atoomstructuur van de materie. In tegenstelling tot de macroscopische benadering is er op deze schaal een korrelige structuur met gaten en ruimtes tussen de moleculen, atomen en zelfs binnen deze.
Het andere kenmerk van het microscopische oogpunt in de fysica, is dat een stuk materie ongeacht hoe klein, is samengesteld uit een groot aantal deeltjes gescheiden van elkaar en in continue beweging.
-Materie is een enorme leegte
In een kleine taart.
Dat wil zeggen, een stuk materie op microscopische schaal is een enorme leegte met concentraties van atomen en kernen die een zeer kleine fractie van het totale volume innemen. In die zin heeft de microscopische schaal gelijkenis met de astronomische schaal.
Van macroscopische objecten voor de ontdekking van het atoom
De eerste chemicaliën, die de alchemisten waren, realiseerden zich dat de materialen van twee soorten konden zijn: pure of verbindingen. Dit bereikte het idee van de chemische elementen.
Het kan u van dienst zijn: Drukgradiënt: wat is het en hoe het wordt berekendDe eerste chemische elementen werden ontdekt, waren de zeven metalen van de oudheid: zilver, goud, ijzer, lood, blik, koper en kwik. In de loop van de tijd werden ze meer ontdekt in de mate dat stoffen werden gevonden die niet in andere konden ontleden.
Vervolgens werden de elementen geclassificeerd volgens hun eigenschappen en kenmerken in metalen en niet -metalen. Allen die vergelijkbare chemische eigenschappen en affiniteit hadden.
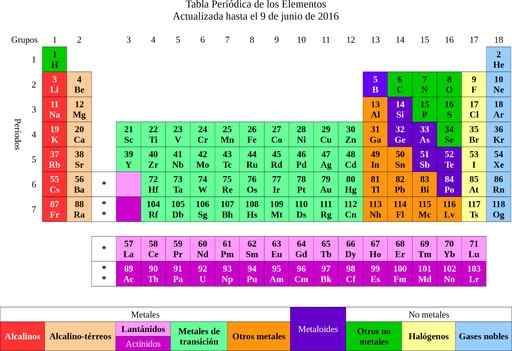 Figuur 2. periodiek systeem der elementen. Bron: Wikimedia Commons.
Figuur 2. periodiek systeem der elementen. Bron: Wikimedia Commons. Uit de elementen ging het naar het idee van atomen, een woord dat ondeelbaar betekent. Korte tijd later merkten de wetenschappers dat de atomen een structuur hadden. Bovendien hadden de atomen twee soorten elektrische lading (positief en negatief).
Subatomische deeltjes
In de experimenten van Rutherford waarin hij de atomen van een dunne gouden plaat met alfa -deeltjes bombardeerde, werd de structuur van het atoom onthuld: een kleine positieve kern omgeven door elektronen.
Ze bleven de atomen van meer en meer energiedeeltjes bombarderen en nog steeds worden gedaan, om de geheimen en eigenschappen van de microscopische wereld in toenemende mate op kleinere schaal te ontrafelen.
Op deze manier werd het standaardmodel bereikt, dat vaststelt dat de ware elementaire deeltjes die zijn waarvan de atomen zijn samengesteld. Op hun beurt geven atomen aanleiding tot de elementen, deze aan de verbindingen en alle bekende interacties (behalve zwaartekracht). In totaal zijn er 12 deeltjes.
Deze fundamentele deeltjes hebben ook hun periodieke tabel. Er zijn twee groepen: de fermionische spin -deeltjes ½ en de bosonic. Bosonic is verantwoordelijk voor interacties. De fermionica zijn 12 en zijn degenen die aanleiding geven tot protonen, neutronen en atomen.
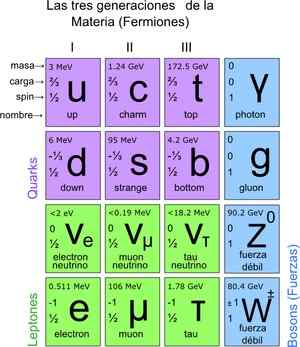 figuur 3. Fundamentele deeltjes. Bron: Wikimedia Commons.
figuur 3. Fundamentele deeltjes. Bron: Wikimedia Commons. Hoe deeltjes te tellen op microscopische schaal?
Na verloop van tijd ontdekten de chemici de relatieve massa's van de elementen van precieze metingen in chemische reacties. Er kan bijvoorbeeld worden vastgesteld dat koolstof 12 keer zwaarder is dan waterstof.
Er werd ook vastgesteld dat waterstof het lichtste element is, zodat dit element de relatieve massa is toegewezen 1.
Aan de andere kant moeten chemicaliën het aantal deeltjes kennen bij een reactie, zodat geen van beide reagens ontbreekt. Een watermolecuul vereist bijvoorbeeld twee waterstofatomen en één zuurstof.
Kan u van dienst zijn: golvende fenomenenUit deze achtergrond wordt het concept van mol geboren. Een mol elke stof is een vaste hoeveelheid deeltjes die gelijkwaardig is aan zijn moleculaire of atomaire massa in gram. Aldus werd vastgesteld dat 12 gram koolstof hetzelfde aantal deeltjes heeft als 1 gram waterstof. Dat nummer staat bekend als het Avogadro -nummer: 6.02 x 10^23 deeltjes.
-voorbeeld 1
Bereken hoeveel gouden atomen er zijn in 1 gram goud.
Oplossing
Het is bekend dat goud een atoomgewicht van 197 heeft. Deze gegevens zijn te vinden in de periodiek systeem en geeft aan dat een goudatoom 197 keer zwaarder is dan een van waterstof en 197/12 = 16.416 keer zwaarder dan koolstof.
Een gouden mol heeft 6,02 × 10^23 atomen en heeft het atoomgewicht uitgedrukt in gram, dat wil zeggen 197 gram.
In een gram goud is er 1/197 mol goud, dat wil zeggen 6,02 × 10^23átomos/197 = 3,06 x10^23 gouden atomen.
-Voorbeeld 2
Bepaal het aantal calciumcarbonaatmoleculen (CACO3) dat er in 150 gram van deze stof is. Zeg ook hoeveel calciumatomen, hoeveel koolstof en hoeveel zuurstof er in deze verbinding zijn.
Oplossing
Het eerste is om de moleculaire massa van calciumcarbonaat te bepalen. Het periodieke tabel geeft aan dat calcium een molecuulgewicht heeft van 40 g/mol, koolstof 12 g/mol en zuurstof 16 g/mol.
Dan de moleculaire massa van (caco3) zijn :
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Elke 100 gram calciumcarbonaat is 1mol. Dan komt in 150 gram overeen met 1,5 mol.
Elk mol carbonaat heeft 6,02 x 10^23 carbonaatmoleculen, dus in 1,5 mol carbonaat zijn er 9,03 x 10^23 moleculen.
Samenvattend, in 150 gram calciumcarbonaat zijn er:
- 9.03 x 10^23 calciumcarbonaatmoleculen.
- Calciumatomen: 9,03 x 10^23 .
- Ook 9.03 x 10^23 koolstofatomen
- Eindelijk 3 x 9,03 x 10^23 zuurstofatomen = 27,09 x 10^23 zuurstofatomen.
Referenties
- Toegepaste biologie. Wat zijn de microscopische maatregelen?. Hersteld van: YouTube.com
- Chemisch onderwijs. Macroscopische, submicroscopische en symbolische representaties over materie. Hersteld van: Scielo.borg.mx.
- Garcia a. Interactieve natuurkundecursus. Macro -state, microstaten. Temperatuur, entropie. Opgehaald uit: SC.Ehu.is
- De microscopische structuur van materie. Hersteld van: Alipso.com
- Wikipedia. Microscopisch niveau. Hersteld van: Wikipedia.com

