Chemical Balance -verklaring, factoren, typen, voorbeelden

- 4474
- 82
- Pete Heaney V
Hij chemische balans Het is een toestand die de omkeerbare chemische reacties bereikt waarin geen variatie van concentraties of reagentia, noch van de betrokken producten wordt geproduceerd. Het wordt gekenmerkt door dynamisch en niet statisch te zijn; dat wil zeggen, de moleculen of atomen blijven reageren, maar behouden dezelfde concentraties gedurende de tijd.
Een vergelijkbare balans wordt ook gepresenteerd in faseveranderingen, hoewel er geen linkbreaks zijn. Een vloeistof kan bijvoorbeeld in evenwicht zijn met zijn dampen, evenals als een vaste stof. Evenzo vestigt een vaste stof een balans met de wateren eromheen wanneer deze is neergeslagen of gekristalliseerd.
 In de chemische industrie is kennis van de chemische balans essentieel om synthese te verkrijgen met betere opbrengsten. Bron: Pxhere.
In de chemische industrie is kennis van de chemische balans essentieel om synthese te verkrijgen met betere opbrengsten. Bron: Pxhere. Zodra het chemische evenwicht is vastgesteld, is het niet mogelijk om meer wijzigingen of antwoorden te verkrijgen, tenzij het wordt onderbroken of beïnvloed door externe acties. Het is dus, in de synthese van een product, worden verschillende parameters zoals druk, volume of temperatuur gemodificeerd, zodat de maximale hoeveelheid product in evenwicht wordt gegenereerd.
Anders zullen de hoeveelheden producten in balans onbevredigend zijn; dat wil zeggen, er zullen een slechte reactieprestaties zijn. Dat is de reden waarom de chemische balans van vitaal belang is voor de chemische industrie, en in het algemeen voor elke synthese, ongeacht de schaal.
In chemisch evenwicht kunnen er meer producten zijn, of meer reagentia. Het hangt allemaal af van waar de balans is verplaatst. Rekening houdend met verschillende factoren, kunt u een saldo verplaatsen naar een van de twee richtingen van de dubbele pijl in de omkeerbare reactie.
[TOC]
Verklaring van de chemische balans
Voor balans
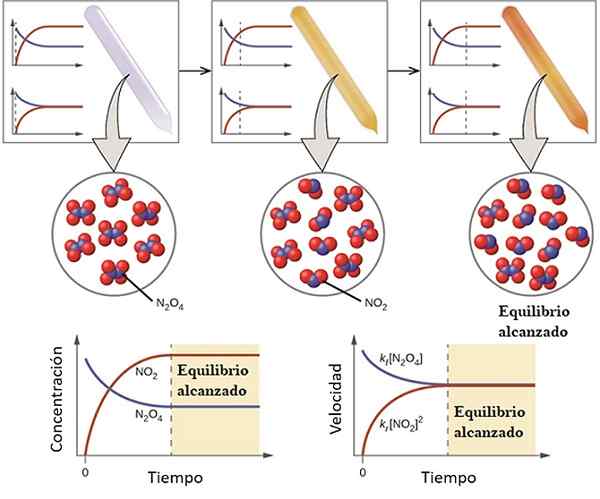 Voorbeeld van hoe een reactie zijn evenwicht nadert. Bron: OpenStax/CC door (https: // creativeCommons.Org/licenties/door/4.0)
Voorbeeld van hoe een reactie zijn evenwicht nadert. Bron: OpenStax/CC door (https: // creativeCommons.Org/licenties/door/4.0) Om te begrijpen wat de chemische balans is beschouwen als de volgende omkeerbare reactie:
N2OF4(g) ⇌ nee2(G)
Het gas n2OF4 Het is kleurloos, terwijl het gas dat niet doet2 presenteert een bruine of bruine kleuring. Als een specifieke hoeveelheid N wordt geïnjecteerd in een kleine flesje of container2OF4, Dit zal kleurloos zijn totdat de balans is vastgesteld.
Links van het bovenste beeld is te zien dat bijna alle moleculen van n zijn2OF4 en dat de concentratie van nee2 Het is nul.
Toon ook twee grafieken die weergeven hoe de trend in de balans is, met de stippellijn die de positie wijst op het moment dat alleen de N wordt geïnjecteerd2OF4. Een grafiek komt overeen met concentratie versus. Tijd (downst hand) en de andere komt overeen met de grafiek met snelheid versus. Tijd (rechterhand).
De concentratie van n2OF4, [N2OF4] (blauwe lijn) zal geleidelijk afnemen, omdat een deel ervan zal dissociëren om moleculen van NO te produceren2. Dus de concentratie van NO2, [NEE2] (rode lijn) gelijk aan nul in het begin, zal binnenkort toenemen als de n2OF4 Dissociëren.
Het is echter een omkeerbare reactie: een deel van de no moleculen2 Ze zullen meedoen om N te vormen2OF4. Er zullen daarom twee reacties zijn, de directe en het omgekeerde, elk met zijn eigen snelheden.
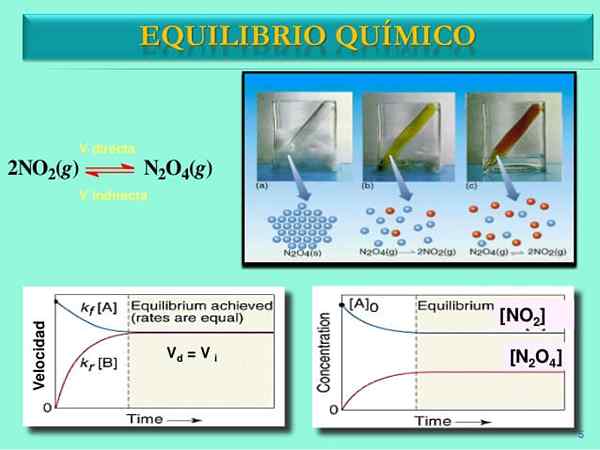 Bron: Slideshare.netto
Bron: Slideshare.netto Reactiesnelheid
In het begin is de consumptiesnelheid van N2OF4 is groter dan de consumptiesnelheid van NO2. Het is duidelijk dat alleen n2OF4, de weinige moleculen gevormd uit NO2 Ze kunnen zich nauwelijks merken om te reageren. Op dit punt begint de flacon oranje te tonen, omdat er een mengsel van n is2OF4 en niet2.
Beetje bij beetje, omdat er meer moleculen van NO zijn2 In de weg en dat de n moleculen2OF4 Ze dissociëren, de snelheden van de twee reacties zullen overeenkomen, zelfs als de concentraties van elkaar verschillen. Dat wil zeggen, nee2] is meestal groter dan [n2OF4], daarom staat de rode lijn boven de blauwachtige lijn.
Kan u van dienst zijn: fysicochemische eigenschappenMerk op dat de snelheid DC/dt wordt, dat wil zeggen de concentratieverandering ten opzichte van de tijd. Dat is de reden waarom de twee C VS. t en V Vs. t zijn niet identiek.
Per saldo
Zodra het paar n2OF4-NEE2 Stel de balans in, de snelheden van beide reacties zullen worden gekoppeld en de volgende wiskundige uitdrukkingen zullen worden verkregen:
Vbesturen = K1[N2OF4]
Vachteruit = K-1[NEE2]2
Vbesturen = Vachteruit
k1[N2OF4] = K-1[NEE2]2
k1/K-1 = [Nee2]2/ [N2OF4]
Keq = [Nee2]2/ [N2OF4]
Op dit punt zal de weg nog meer dan bruin worden geverfd, omdat de balans meer ontheemd is in de richting van de vorming van [nee2]. Dat wil zeggen keq, De evenwichtsconstante moet groter zijn dan 1, rekening houdend met de hogere relatie, [nee2]2/ [N2OF4].
In balansconcentraties [n2OF4] en niet2] Ze blijven constant, waarbij beide reacties met dezelfde snelheid plaatsvinden: een bepaalde hoeveelheid N is gewoon gedissocieerd2OF4, Dezelfde hoeveelheid zal onmiddellijk worden geproduceerd vanwege de reactie van een bepaalde hoeveelheid NO2.
Om deze reden wordt gezegd dat de chemische balans dynamisch is: de moleculen n2OF4 en niet2 Ze nemen nog steeds deel aan reacties, zelfs als er geen verandering in hun concentraties is.
En de gelijke reactiesnelheden zijn voor beide zintuigen, de rode en blauwachtige lijn in de afbeeldingen V Vs. t speel op een horizontale lijn.
Evenwichtsconstante
De evenwichtsconstante voor de vorige reactie zal altijd hetzelfde zijn, op een bepaalde temperatuur, ongeacht hoeveel n2OF4 wordt in het begin op de weg geïnjecteerd. Dit zal zo zijn, zelfs als een mengsel van N rechtstreeks wordt geïnjecteerd2OF4 en niet2, vervolgens in rust vertrokken totdat het saldo bereikt.
Wanneer de balans wordt bereikt en de concentraties worden gemeten [n2OF4] en niet2], de relatie [nee2]2/ [N2OF4] zal hetzelfde geven aan keq Voor deze reactie. Hoe groter het is (keq >> 1), hoe meer producten er in balans zullen zijn. En de kleinere (keq << 1), más reactivos habrá en el equilibrio.
Concentraties [n2OF4] en niet2] Ze zullen niet altijd. Als bijvoorbeeld kleine volumes in de flacon worden geïnjecteerd, of als ze daarentegen zijn geïnjecteerde torrents van deze gassen in een reactor, zullen de hoeveelheden aanzienlijk variëren. Maar Keq Het blijft hetzelfde zolang de temperatuur in beide processen hetzelfde is.
Keq Het is vatbaar voor temperatuurveranderingen: bij een hogere temperatuur zal een grotere waarde zijn. Dat wil zeggen, bij een hogere temperatuur, zal het de vorming van meer producten neigen. Dit is zo tenzij de reactie exotherme is, zoals in de volgende sectie zal worden verklaard.
Factoren die de chemische balans beïnvloeden
De factoren die de chemische balans in een omkeerbare reactie beïnvloeden, zijn: concentratie, druk en temperatuur.
- Concentratie
In een omkeerbare reactie, volgens het principe van Le Chatlier, zal er door de concentratie van een reagens een verplaatsing van de chemische balans aan de rechterkant te verhogen, om de concentratie van de reactieproducten te verhogen.
Integendeel, als een product aan de reactie wordt toegevoegd, zal de chemische balans naar links gaan, om de concentratie van de reagentia te vergroten. Als de volgende reactie als voorbeeld wordt opgevat:
C (s) +o2(g) ⇌ 2 CO (g)
Door de concentratie van de reagentia te vergroten (C en O2), De balans zal naar rechts gaan, dat wil zeggen naar de vorming van het koolmonoxide (CO) -product (CO). Maar een toename van de Ca -concentratie zal een verplaatsing van het evenwicht naar links veroorzaken, om de concentratie van C en O te verhogen2.
Het kan u van dienst zijn: carbonylgroep: kenmerken, eigenschappen, nomenclatuur, reactiviteit- Druk
In een reactie die in de gasfase is ontwikkeld, zal een variatie in het volume of in de druk uitgeoefend op de erbij betrokken gassen een wijziging in de balans veroorzaken, afhankelijk van het aantal mol van de reagentia en de producten.
Als de componenten van een reactie (reagentia en producten) verschillen hebben in het aantal mol bij een reactie, bijvoorbeeld, de dimerisatie van stikstofdioxide (nee2):
2 Nee2(g) ⇌2OF4(G)
Een toename van de druk op de reactie in een gasfase, een gevolg van een afname of niet van het volume van de reactie, zal een verplaatsing van de chemische balans veroorzaken naar de zijkant die minder gas mol heeft. In dit voorbeeld: product n2OF4.
Integendeel, een afname van de druk zal een verplaatsing van de balans aan de zijkant van de reactie veroorzaken die het grootste aantal mol gas bezit. In het gegeven voorbeeld zal het naar de reagentia gaan (nee2), Om de afname van de druk tegen te gaan.
Als de mol van de reagentia in een frisdrankfase -reactie gelijk zijn aan de mol van de producten, hebben de veranderingen in de druk geen invloed op de chemische balans.
- Temperatuur
Endotherme reactie
In een endotherme reactie kan warmte worden beschouwd als een reagens, omdat de toevoer ervan nodig is om de reactie op te treden:
A +Q ⇌ B
Q = Warmte geleverd
Daarom, in een endotherme reactie wanneer de temperatuur stijgt, zal de balans naar rechts gaan. Ondertussen, wanneer de temperatuur daalt, beweegt de balans naar links.
De warmte die deel uitmaakt van de reagentia, om het te consumeren om te transformeren in B.
Exotherme reactie
In een exotherme reactie wordt warmte gegenereerd, dit is een product van de reactie:
A ⇌ B +Q
In een exotherme reactie wanneer de temperatuur stijgt, zal de balans naar links (reagentia) bewegen, omdat de warmteproductie toeneemt. Ondertussen, wanneer de temperatuur daalt, zal de balans naar rechts gaan (producten).
De warmte die deel uitmaakt van de producten, wanneer de temperatuur stijgt, is het niet nodig om meer warmte bij te dragen aan de omgeving. En daarom zal balans proberen te profiteren van extra hitte om meer reagentia te produceren; In dit geval, meer dan.
Typen chemische balans
Afhankelijk van de fysieke toestand van de reactiecomponenten kan chemische balans homogeen of heterogeen zijn.
Homogene balans
In dit soort balans, alle Reagentia en producten hebben dezelfde fase- of vloeistofstatus. Bijvoorbeeld:
N2(g) +3 H2(g) ⇌ 2 NH3(G)
Hier is zo2, zoals h2 en de NH3 Het zijn gasvormige stoffen.
Heterogene balans
Bestaat wanneer Niet alles Reagentia en producten hebben dezelfde fase of fysieke conditie. Bijvoorbeeld:
2 Nahco3(s) ⇌ NA2CO3(s) +co2(g) +H2O (g)
Hier hebben we de nahco3 en NA2CO3 als vaste stoffen, en de CO2 en h2Of als gassen of dampen.
Voorbeelden van chemische balans
Dissociatie van azijnzuur in water
Azijnzuur, cho3COOH, dissocieert in water dat een evenwicht vestigt:
Ch3COOH (AC) + H2Of (l) ⇌ cho3Coo-(AC) + H3OF+(AC)
Reactie waarvan de evenwichtsconstante zuurgraad constant wordt genoemd.
Isomerisatieofn van de butane
Het gas N-Butano kan worden geïsomeriseerd volgens de volgende omkeerbare reactie om het isomeer -isomeer te produceren:
Ch3Ch2Ch2Ch3(g) ⇌ cho3CH (Ch3))2(G)
Stikstofoxide -vorming in de atmosfeer
In de atmosfeer kan stikstofmonoxide worden gevormd, hoewel zeer nauwelijks, uit stikstof- en luchtzuurstof:
N2(g) + of2(g) ⇌ 2no (g)
Het kan je van dienst zijn: wat is de miliequivalente? (Berekeningsvoorbeelden)De Keq Uit deze reactie is 2 · 10-31 bij 25 ºC, dus een verachtelijke hoeveelheid NO zal worden gevormd.
ReactieofN van zilveren comproductie met AmonJeAC
Zilverionen, Ag+, Ze kunnen worden voltooid met de ammoniak volgens de volgende omkeerbare reactie:
Ag+(Zon) + 2nh3(L) ⇌ [AG (NH3))2]+(zon)
Opgeloste oefeningen
Oefening 1
Welk type chemisch evenwicht komt overeen met de volgende reactie?
2nocl (g) ⇌ 2no (g) + cl2(G)
Deze reactie komt overeen met een homogeen evenwicht, omdat alle betrokken stoffen, NOCL, NO en CL2, Het zijn gassen.
Oefening 2
Voor dezelfde reactie van bovenaf, welke verandering in evenwicht zou kunnen worden verwacht als de druk plotseling toeneemt?
Laten we de mol van de reagentia tellen:
2nocl
We hebben 2 mol NOCL. Laten we nu de mollen van de producten vertellen:
2no + Cl2
We hebben drie mol: twee van NO, en een van CL2. Er zijn meer gasvormige moedervlekken aan de zijkant van de producten. Daarom zal een toename van de druk ervoor zorgen dat de balans naar de linkerkant gaat, naar de vorming van NOCL. Op deze manier probeert het systeem de effecten van druk te verzachten die de vorming van NOCL bevorderen en niet van NO en CL2.
Oefening 3
Stel voor dezelfde reactie van bovenaf dat een aanzienlijk volume CL plotseling wordt geïnjecteerd2. Wat zal er gebeuren met balans?
Bij het toevoegen van CL2 naar de reactor of container, neemt de concentratie toe als een product van de reactie. En daarom zal de balans terug naar links gaan, om meer NOCL te vormen.
Oefening 4
Als de dissociatie van NOCL bij 227 ºC een 4 evenwichtsconstante van 4 heeft.5 · 10-4, In welke richting is de balans die wordt verplaatst?
Nogmaals, K zijneq Minder dan 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, Omdat het naar links is verplaatst.
Oefening 5
Volgens de volgende reactie in balans:
[CO (oh2))6]2+(AC) +4cl-(AC) +Q ⇌ [Cocl4]2-(AC) +6H2Of (l)
En wetende dat het complex [co (oh2))6]2+ Het is roze en dat het complex [cocl is4]2- Het is blauwachtig, welke veranderingen zou je verwachten te zien of je een container verwarmt met [CO (oh2))6]2+? Wat zou je verwachten te zien of ik na het verwarmen van de container het in een badkamer met ijs zou plaatsen?
De reactie is endotherme, omdat deze warmte absorbeert als een reagens. Daarom bij het verwarmen van de container met [co (oh2))6]2+, De balans zal naar rechts gaan, naar de vorming van [cocl4]2-. Een blauwachtige roze kleurverandering zal zijn.
Dan, als de blauwachtige kleurcontainer met [cocl4]2- Het wordt in een badkamer met ijs geplaatst, de reactie zal nu naar links gaan, naar de vorming van CO (oh2))6]2+:
[Cocl4]2-(AC) +6H2Of (l) ⇌ [co (oh2))6]2+(AC) +4cl-(AC) +Q
Dit komt omdat de omgekeerde reactie exotherme is, met de hitte die als product. Daarom bij het afkoelen van de container met [cocl4]2- Blauw, het complexe [co (oh (oh2))6]2+, En de roze kleur zal opnieuw verschijnen.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Emedische prep. (S.F.)). Soorten balans. Hersteld van: EmedicPrep.com
- Lumen grenzeloze chemie. (S.F.)). Factoren die chemische balans apfecteren. Hersteld van: cursussen.Lumenarning.com
- Wikipedia. (2020). Chemische balans. Opgehaald uit: in.Wikipedia.borg
- Chemistry Libhethexts. (24 mei 2020). Equiquibriumberekeningen - Sub illustratieve voorbeelden. Hersteld van: chem.Librhetxts.borg
- Meyers Amy. (2020). Evenwicht: chemisch en dynamisch. Studie. Hersteld van: studie.com
- Helmestine, Anne Marie, pH.D. (11 februari 2020). Chemische balans bij chemische reacties. Hersteld van: Thoughtco.com
- « Guatemala culturen kenmerken, tradities en gewoonten
- Foundation -elektroforese, techniek, waar is het voor, voorbeelden »

