Reactie -enthalpie, thermochemie, oefeningen

- 1503
- 21
- Cecil Graham
De Reactie enthalpie Het is een thermodynamische functie waarmee u de verworven of afgegeven warmte kunt berekenen of geleverd, op voorwaarde dat deze reactie heeft plaatsgevonden bij constante druk. Het wordt gedefinieerd als interne energie of plus het product van de druk P op volume V van de stoffen die betrokken zijn bij een chemische reactie, als volgt: h = u + p ∙ v
Daarom heeft enthalpie dimensies van energie en in het internationale systeem van maatregelen wordt het gemeten in joules. Om de relatie van enthalpie te begrijpen met de warmte die in een chemische reactie is uitgewisseld, is het noodzakelijk om de eerste wet van de thermodynamica te onthouden, die het volgende vaststelt: Q = Δu + w
 Figuur 1. Bij de verbranding van een gas neemt de enthalpie af. Bron: Pixabay
Figuur 1. Bij de verbranding van een gas neemt de enthalpie af. Bron: Pixabay De eerste wet stelt vast dat de warmte die in een thermodynamisch proces is uitgewisseld, gelijk is aan de variatie van de interne energie van de bij het proces betrokken stoffen plus het werk dat door deze stoffen wordt uitgevoerd in het proces.
In elk proces wordt W -werk berekend door de volgende relatie:

In de vorige uitdrukking is VI het initiële volume, vf het uiteindelijke volume en p de druk. Als het proces wordt uitgevoerd onder constante druk P, dan is het resulterende werkzaamheden:
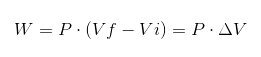
Waarbij ΔV de volumevariatie is.
[TOC]
Definitie
Chemische reacties zijn thermodynamische processen die in het algemeen optreden onder constante druk en zeer vaak bij atmosferische druk. Dit type thermodynamische processen wordt "isobarisch" genoemd, omdat het optreedt bij constante druk.
In dit geval kan de eerste wet van de thermodynamica als volgt worden geschreven:
Qp = Δu + p ∙ ΔV
Waar QP aangeeft dat warmte is uitgewisseld bij constante druk. Als de definitie van enthalpie h = u + p ∙ v verkregen dan:
Qp = ΔH
Van daaruit moet je positieve enthalpie veranderen, duidt op een reactie die warmte uit de omgeving heeft genomen. Dit is een endotherme reactie.
Kan u van dienst zijn: ton: transformaties, gelijkwaardigheid en oefeningen opgelostIntegendeel, als de verandering van enthalpie negatief is, is het dan een exotherme reactie.
In feite komt het woord enthalpie uit het Griekse woord Enthalpien, wiens betekenis "warmte" is.
Vaak wordt de enthalpie ook warmte genoemd. Maar het moet duidelijk zijn dat het niet hetzelfde is als warmte, maar het is de uitwisseling van warmte tijdens het thermodynamische proces dat de enthalpie verandert.
Hitte -relatie
In tegenstelling tot hitte is enthalpie een staatsfunctie. Wanneer de veranderingsverandering wordt berekend, worden het verschil van twee functies die uitsluitend afhankelijk zijn van de status van het systeem, zoals interne energie en volume berekend.
ΔH = Δu + p ∙ Δv
Zoals bij de reactie blijft de druk constant, dus de reactie -enthalpie is een toestandsfunctie die alleen afhankelijk is van interne energie en volume.
In een chemische reactie kan de enthalpie van de reagentia worden gedefinieerd als de som van die van elk van hen; en die van producten als de som van de enthalpie van alle producten.
De verandering van enthalpie in een reactie is het verschil van dat van de producten behalve die van de reagentia:

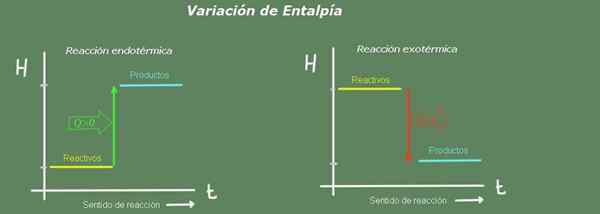 Figuur 2. Enthalpie -diagram. Bron: zelf gemaakt.
Figuur 2. Enthalpie -diagram. Bron: zelf gemaakt. In een endotherme reactie is de enthalpie van de producten groter dan die van de reagentia; dat wil zeggen, de reactie haalt warmte uit de omgeving. Integendeel, in een exotherme reactie is de enthalpie van de reagentia groter dan die van de producten, omdat de reactie warmte aan de omgeving geeft.
Standaard enthalpie
Omdat de verandering van enthalpie in een chemische reactie kan afhangen van druk en temperatuur, is het gebruikelijk om de standaardreactieomstandigheden te definiëren:
Het kan u van dienst zijn: Kalibratiecurve: waar is het voor, hoe het te doen, voorbeeldenStandaard reactietemperatuur: 25 ° C.
Standaard reactiedruk: 1 atm = 1 bar.
Standaard enthalpie wordt als volgt aangegeven: H °
Thermochemie
In een thermochemische vergelijking is niet alleen belangrijk reagentia en producten, de variatie van enthalpie is ook belangrijk. Enthalpy wordt opgevat als de reactie op de verandering van haar die plaats had tijdens hetzelfde.
Laten we bijvoorbeeld de volgende reacties bekijken:
2 H2 (gas) + O2 (gas) → 2 H2O (vloeistof); ΔH ° = -571,6 kJ (exotherme).
H2 (gas) + (½) O2 (gas) → H2O (vloeistof); ΔH ° = -285,8 kJ (exotherme).
2 H2O (vloeistof) → 2 H2 (gas) + O2 (gas); ΔH ° = +571,6 kJ (endotherm).
Enthalpy is een uitgebreide thermodynamische hoeveelheid
Als de termen van een chemische vergelijking worden vermenigvuldigd of gedeeld door een bepaalde factor, wordt de enthalpie erdoor vermenigvuldigd of verdeeld.
Als de reactie wordt geïnvesteerd, wordt het teken van de reactie -enthalpie ook geïnvesteerd.
Opgeloste oefeningen
-Oefening 1
C2H2 -acetyleengas wordt verkregen uit de CAC2 -calciumcarbide -reactie die op een granuleerde manier wordt geleverd met water in milieu en omgevingsdruk.
Als gegevens zijn er enthalpies van reagensvorming:
ΔH ° (cac2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
En de enthalpie van productvorming:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Zoek de standaardtropie van de reactie.
Oplossing
Het eerste is om de evenwichtige chemische vergelijking te verhogen:
CAC2 (s) + 2H20 (L) → Ca (OH) 2 (S) + C2H2 (G)
En nu de enthalpieën van de reagentia, producten en de reactie:
- Reagentia: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
- Producten: -986.0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Het kan u van dienst zijn: wat zijn coplanares vectoren? (Met opgeloste oefeningen)- Reactie: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Het is een exotherme reactie.
-Oefening 2
Wanneer 1 liter acetyleen brandt in standaardomstandigheden, hoeveel warmte maakt het los?
Oplossing
De verbrandingsreactie van acetyleen zodra evenwichtig is, is als volgt:
C2H2 (G) + (5/2) O2 (G) → 2 CO2 (G) + H20 (L)
We hebben enthalpies van producttraining nodig:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Berekening van enthalpieën
Met deze gegevens kunnen we de enthalpie van de producten berekenen:
ΔH ° (producten) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
En de reagensvorming enthalpie:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (o2) = 0,0 kJ/mol
De enthalpie van de reagentia zal zijn:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
De molaire reactie -enthalpie zal dan zijn: ΔH ° (producten) - ΔH ° (reagentia) = -1072.8KJ/mol - 227,0 kJ/mol = -1299,8 kJ/mol/mol
Verbranding enthalpie
Nu moeten we weten hoeveel mol acetyleen een liter acetyleen zijn in standaardomstandigheden. Hiervoor zullen we de staatsvergelijking van een ideaal gas gebruiken, van waaruit we het aantal mol zullen vrijmaken.
Aantal mol n = p*v/(r*t)
P = 1 atm = 1.013 x 10⁵ PA
V = 1 l = 1,0 x 10^-3 m³
R = 8.31 J/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
De enthalpie van de verbranding van 1 liter acetyleen is 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Het negatieve teken geeft aan dat het een exotherme reactie is die 53,13 kJ = 12,69 kcal afgeeft.
Referenties
- Castaños e. Enthalpie in chemische reacties. Hersteld van: Lidiaconlachimica.WordPress.com
- Thermochemie. Reactie enthalpie. Opgehaald uit: bronnen.onderwijs.is
- Thermochemie. Definitie van standaardreactie -enthalpie. Hersteld van: Quimitube.com
- Wikipedia. Standaardreactie -enthalpie. Hersteld van: Wikipedia.com
- Wikipedia. Training Enthalpy. Hersteld van: Wikipedia.com
- « Relatieve foutformules, hoe het wordt berekend, oefeningen
- Wat is de opdrachtinspanning en hoe deze te verkrijgen? »

