Chemische binding
- 4601
- 1481
- Glen Armstrong
We leggen uit wat de chemische links zijn, de typen die bestaan, en we geven veel voorbeelden
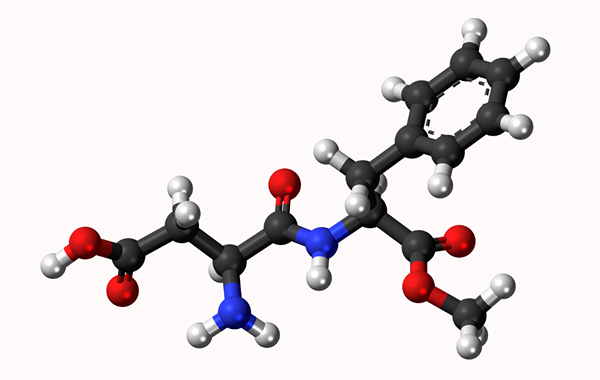
 Aspartamo moleculair model: eenvoudige link weergegeven door een lijn en dubbele binding door twee lijnen. De ballen zijn atomen
Aspartamo moleculair model: eenvoudige link weergegeven door een lijn en dubbele binding door twee lijnen. De ballen zijn atomen Wat is een chemische binding?
A Chemische binding Het is de kracht die bij elkaar blijft met de atomen van een verbinding. De kracht die atomen verenigt, is elektromagnetisch, en wanneer de atomen zijn gebonden, behouden ze hun eigen aard.
Er wordt bijvoorbeeld gemeenschappelijk water gevormd vanwege de vereniging van twee waterstofatomen (h2) en een van zuurstof (O); Daarom is de chemische formule H2OF. Hoewel ze verenigd zijn om water te vormen, blijven waterstofatomen waterstof en zuurstof is nog steeds zuurstof.
Bedenk dat atomen worden gevormd door een kern omgeven door een wolk van elektronen, die een negatieve belasting hebben. De kern van het atoom heeft een positieve lading, die erin slaagt elektronen aan te trekken.
Elektronen worden echter ook aangetrokken tot de kernen van andere atomen. Dit is hoe chemische links worden gevormd. Het feit dat atomen elektronen opleveren of delen, genereert de verschillende soorten chemische links.
In chemische bindingen geven atomen elektronen op, winnen of delen ze van wat Valencia -laag wordt genoemd, de buitenste laag van een atoom waar reactiviteit optreedt of de neiging om chemische bindingen te vormen.
Deze links maken nieuwe stoffen (geen mengsels) die niet kunnen worden gescheiden door technieken zoals zeef of filteren.
Typen chemische binding
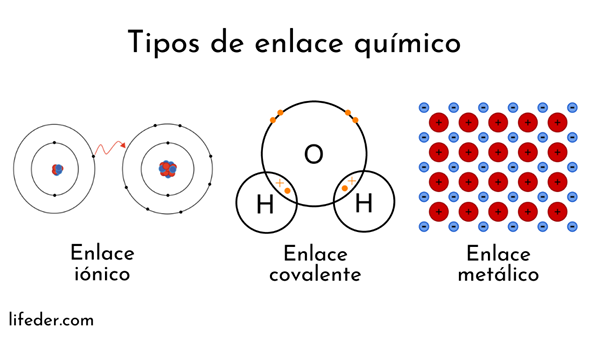
Atomen worden gevormd door een kern (met positieve elektrische lading) en elektronen (deeltjes met negatieve elektrische lading) die ronddraaien. Beide partijen grijpen tussenbeide in chemische bindingen.
Chemische bindingen met atoomkernen worden metallic genoemd. Aan de andere kant zijn die met elektronenuitwisseling verdeeld in ionen en covalent.
Kan u van dienst zijn: chloorbenzeen (c6h5cl)Ionische links
Dit type link is zeer resistent; produceert vaste chemische verbindingen (kristallen) in het water en met een hoog smeltpunt (tussen 300 en 1.000 graden Celsius). Opgelost in water, het zijn elektriciteitsgeleiders.
Hoe zijn ionische links?

Ionische bindingen treden op tussen een metaal en een niet -metaal die verschillende elektronegativiteit hebben (vermogen om elektronen aan te trekken). De elektronen van de Valencia -laag van de ene atoompassing naar het andere atoom van Valencia. Wat hetzelfde is; Een metalen atoom geeft een elektron aan een niet -metalen atoom, waarbij elektronische stabiliteit wordt bereikt.
Gedurende het linkvormingsproces worden ionen (kationen en anionen) gevormd, vandaar de ionische bindingsnaam.
Een voorbeeld van dit type binding is natriumchloride: deze chemische verbinding wordt gevormd wanneer chloor (CL) het elektron van de valentielaag trekt met het natriumatoom (NA).
Een ander voorbeeld is mangaanchloride (MGC), dat wordt gebruikt bij de productie van schilderijen en desinfectiemiddelen. Als gevolg van de chemische binding worden de elektronen van het mangaanatoom geabsorbeerd door het chlooratoom.
Covalente links
De covalente bindingen zijn erg hard en genereren onoplosbare chemische verbindingen met een hoge fusietemperatuur (meer dan 1.000 graden Celsius). Ze leiden geen elektriciteit.
Volgens de manier waarop atomen hun elektronen delen, kunnen covalente bindingen zijn:
- Eenvoudig: Ze delen een paar elektronen (A-A).
- Dubbele: Deel twee elektronenparen (a =).
- Verdrievoudigen: Deel drie elektronenparen (a≡A).
Hoe worden covalente bindingen gevormd?

De covalente binding wordt gevormd wanneer twee niet -metalen elementen elektronen van hun valentielaag delen.
Het kan u van dienst zijn: Rubidio: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikDe uitwisseling van elektronen komt altijd zo voor dat het voldoet aan de octetwet. Dit is een chemisch principe dat stelt dat de meest stabiele configuratie voor een atoom er een is waarin het acht elektronen in zijn buitenste laag heeft.
Een voorbeeld van covalente binding is water (h2OF). Om het watermolecuul te creëren, zijn twee eenvoudige covalente bindingen nodig. In een eenvoudige binding wordt het waterstofelektron gedeeld met zuurstof, en zuurstof deelt een elektron met waterstof.
Een ander voorbeeld van covalente binding is koolstofdioxide (CO2), een van de belangrijkste verantwoordelijke voor het broeikaseffect en klimaatverandering. Om deze verbinding te vormen, creëren koolstof en zuurstof twee dubbele bindingen, dat wil zeggen voor elke link twee paren elektronen delen.
Metalen links
Dit type link gebeurt alleen in metalen elementen. Het bestaat uit de vereniging van de kernen van twee atomen van hetzelfde metalen element samen met hun elektronen.
Metaalverbindingen worden gekenmerkt door effectieve elektriciteitsgeleiders te zijn, met een zeer hoge fusie en kookpunt, en gemakkelijk geoxideerd. Ze zijn ook kneedbaar en bestand tegen kras, zeer solide en sterk.
Hoe zijn metalen links?
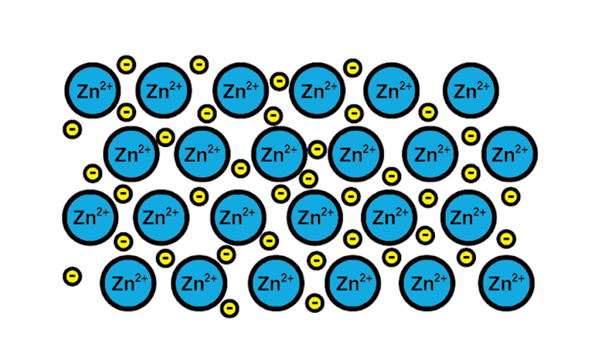 Zinkmetallic link
Zinkmetallic link Een voorbeeld van een metalen link is dat van zink, een metalen element. Het trainingsproces van dit type link is:
1-A atomaire kern van een metaalelement voldoet aan een andere kern van hetzelfde element.
2-De elektronen van de Valencia-laag van beide kernen worden een zee van elektronen rondom. Dat wil zeggen, ze om een enkele atoomkern omdraaien.
3-De positieve belastingen van de atoomkernen en de negatieven van de elektronen worden aangetrokken. Het resultaat is valentie -elektronen die de zee van elektronen rond de atoomkernen vormen (kationen).
Het kan u van dienst zijn: kopersulfaat (CUSO4): structuur, eigenschappen, verkrijgen, gebruikVoorbeelden van chemische binding
Ionische links
- Bariumoxide (BAO).
- Magnesiumchloride (mgcl2)).
- Calciumoxide (Cao)
- Zilvernitraat (agno3))
- Zinkhydroxide (ZnOH2))
- Kaliumbromide (KBR)
- Calciumcarbonaat (caco3))
- Kopersulfaat (Cuo4))
- Lithium fluoride (LIF)
- Mangaanchloride (MNCL2))
- Kaliumsulfaat (k2SW4))
- IJzeroxide (lelijk)
- Disatriumfosfaat (NA2HPO4))
- Kaliumjoduro (ki)
Covalente links
- Koolstofdioxide (CO2))
- Ammoniak (NH3))
- Paraffine (CNH2N+2)
- Diesel (c12H26))
- Dibromo (Br2))
- Koolmonoxide (CO)
- Butano (c4H10))
- Benzeen (c6H6))
- Moleculaire stikstof (n2))
- Methaan (ch4))
- Zoutzuur (HCL)
- Cyanhydrinezuur (HCN)
Metalen links
Elk metaal in zijn pure toestand is een voorbeeld van een metalen link, namelijk:
- Nikkel (Ni)
- IJzer (geloof)
- Aluminium (AL)
- Titanium (ti)
- Lead (PB)
- Kobalt (CO)
- Koper (Cu)
- Zink (Zn)
- Mercurius (HG)
- Goud (au)
- Zilver (AG)
- Barium (BA)
Het belang van chemische bindingen
Het belang van chemische bindingen is dat ze organische en anorganische moleculen vormen, en op deze manier maken ze deel uit van de basis van alle levende organismen. Als ze aan bepaalde voorwaarden worden onderworpen, kunnen deze links worden verbroken. Deze energie wordt genoemd Verbind energie.
Sommige van de technieken om de links te verbreken worden toegepast door elektriciteit, hoge temperaturen of het uitlokken van chemische reacties met verschillende verbindingen.
Bijvoorbeeld om zuurstof- en waterstofmoleculen van H te scheiden2Of we kunnen elektriciteit op het water aanbrengen, wat het proces is dat bekend staat als elektrolyse.
De chemische verbindingen gevormd door link zijn talrijk en zijn aanwezig in het dagelijks leven. Het zout dat we gebruiken om voedsel op smaak te brengen, is een chemisch samengesteld product van het verband tussen een natrium (NA) en één chloor (CL) atoom (CL). De chemische formule is NaCl, dat natriumchloride leest.

