Wat is het meest elektronegatieve element en waarom?

- 1871
- 23
- Dewey Powlowski
 Het meest elektronegatieve element is fluoride (F), vergrendeld in de rode cirkel
Het meest elektronegatieve element is fluoride (F), vergrendeld in de rode cirkel Hij Meer elektronegatief element In het periodiek systeem is het de fluor, wiens chemische stof F is en tot de halogeengroep behoort. Van alle elementen van het periodiek systeem is fluoride het meest angstig om elektronen van andere atomen vast te leggen.
Dit element, gasvormig bij kamertemperatuur, is zeer reactief en daarom is het niet eenvoudig om het in een pure toestand in de natuur te vinden. Fluor verbindt gemakkelijk met andere elementen zoals zwavel, calcium en metalen, evenals talloze verbindingen, vooral die met waterstof.
Met de hoge elektronegativiteit kunt u zelfs combineren met edelgassen zoals Xenon, Kripton en Radon.
Na fluor is zuurstof het tweede element met de hoogste elektronegativiteit. De elementen met de laagste elektronegativiteit zijn daarentegen Francio (FR) en Cesium (CS).
 Omdat het het meest elektronegatieve element is, vormt fluor talloze verbindingen, zoals fluoriet of calciumfluoride. Bron: Wikimedia Commons
Omdat het het meest elektronegatieve element is, vormt fluor talloze verbindingen, zoals fluoriet of calciumfluoride. Bron: Wikimedia Commons Dit zijn daarom het meest elektropositief dat bestaan, hoewel Francio radioactief is en heel weinig overvloedig van aard is.
Elektronegativiteit en periodiek systeem
De schaal van elektronegativiteit werd ontwikkeld door de chemicus en prijs Nobel Linus Pauling (1901-1994), hoewel het concept te wijten is aan de Zweedse chemicus Jöns Jakob Berzelius (1779-1848).
De Pauling -schaal, die dimensionale numerieke waarden toewijst aan elektronegativiteit, wordt gebruikt om de intensiteit te meten waarmee een atoom het elektron van een ander ander atoom aantrekt, en dus links vormt.
Elk element heeft zijn eigen elektronegativiteit, die afhankelijk is van zijn atoomeigenschappen. Het wordt experimenteel en indirect bepaald, bijvoorbeeld het meten van linkergie, zoals Pauling deed rond 1932.
Op de schaal van Pauling Electronegativities is fluoride de eerste, met een geschatte waarde van 3.98 ≈ 4.0.
Kan u van dienst zijn: Alifatische koolwaterstoffen: eigenschappen, nomenclatuur, reacties, typenElektronegativiteit is een periodieke eigenschap van de elementen. In de meeste gevallen (er zijn enkele uitzonderingen), wordt opgemerkt dat elektronegativiteit toeneemt wanneer u van links naar rechts door de gelederen van het periodiek systeem gaat,.
En ook van de onderkant verhogen door op een kolom te bewegen.
 Het periodiek systeem met elektronegativiteiten volgens de Pauling -schaal. Fluorine is het meest elektronegatieve element, boven en rechts, terwijl Francio het minst elektronegatief is van ALL, of de meest elektropositieve, indien gewenst, en zich in de linker- en omlaag bevindt. Bron: f. Zapata.
Het periodiek systeem met elektronegativiteiten volgens de Pauling -schaal. Fluorine is het meest elektronegatieve element, boven en rechts, terwijl Francio het minst elektronegatief is van ALL, of de meest elektropositieve, indien gewenst, en zich in de linker- en omlaag bevindt. Bron: f. Zapata. Fluor elektronegativiteit
De reden dat fluor het meest elektronegatieve element in het periodiek systeem is, is te wijten aan de elektronische configuratie (de manier waarop zijn elektronen zijn gerangschikt in orbitalen rond de kern).
Deze configuratie is 1s22s22 p5, Dus fluoride heeft 5 elektronen in de buitenste laag.
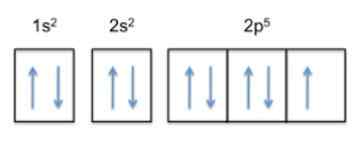
Aangezien de trend van het atoom is om zijn buitenste laag te voltooien, betekent dit dat de fluor een elektron van andere atomen met groot gemak zal accepteren, om stabiliteit te krijgen en op het edelgas van dezelfde rij te lijken, dat is de neon , wiens elektronische configuratie 1s is22s22 p6.
Het fluoratoom heeft een zeer kleine straal, omdat de protonen in hun kern zeer sterk elektronen aantrekken, waardoor ze dichterbij blijven dan in de atomen van minder elektronegatieve elementen, zoals Cessium en Francio.
Daarom zijn de laatste bereid om elektronen gemakkelijk op te geven om links te vormen.
Referenties
- Aguilar, c. Gids voor de chemische leereenheid i. Opgehaald uit: IPN.mx.
- Atkins, P. (2005). Principes van chemie, de paden van ontdekking. 3e. Editie. Pan -Amerikaans medisch redactioneel.
- Clark, J. Elektronegiviteit. Hersteld van: chem.Librhetxts.borg.
- Hein, m. (2014). Foundations of College Chemistry. 14e ed. Wiley.
- Lentech. Chemische elementen besteld door zijn elektronegativiteit. Hersteld van: Lentech.is.

