Drievoudige covalente binding
- 3924
- 500
- Ernesto McKenzie
We leggen uit wat een drievoudige link is, de kenmerken ervan en geven verschillende voorbeelden
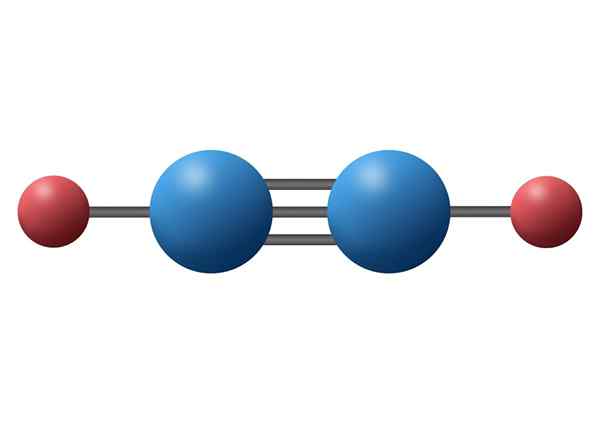 Acetyleenmolecuul (C2H2) met zijn drievoudige binding tussen de twee koolstofatomen
Acetyleenmolecuul (C2H2) met zijn drievoudige binding tussen de twee koolstofatomen Wat is een drievoudige covalente link?
De drievoudige covalente bindingen Het zijn chemische links waarin twee atomen drie paar elektronen delen. Met andere woorden, het zijn covalente bindingen gevormd door in totaal zes valentie -elektronen die rond twee atomen draaien.
Er zijn veel chemische verbindingen die drievoudige links bevatten. Organische verbindingen zoals alkynes bevatten bijvoorbeeld drievoudige C-C-covalente bindingen. Nitrillen worden ook gekenmerkt door een groep te hebben die een koolstof bevat die is gekoppeld aan stikstof door middel van een drievoudige C-N covalent binding. Andere anorganische verbindingen zoals moleculaire stikstof in de lucht, bevatten ook drievoudige covalente bindingen.
Het hebben van 6 elektronen die twee kernen omdraaien, geeft drievoudige links veel specifieke kenmerken. Zowel de vorm van de moleculen die ze bevatten, als de chemische reacties waaraan ze kunnen deelnemen, verschillen van die van dubbele of eenvoudige bindingen.
Drievoudige covalente linkkarakteristieken
Ze worden gevormd door 6 elektronen
Deze obligaties worden gevormd door 6 elektronen en worden gevormd wanneer elk van de twee atomen betrokken zijn drie van zijn verdwenen elektronen met de andere. Dit is de reden waarom ze drievoudige links worden genoemd, omdat ze het aantal elektronen van de eenvoudige covalente binding hebben drievoudig.
Ze hebben een sigma -link (σ) en twee pi (π) links
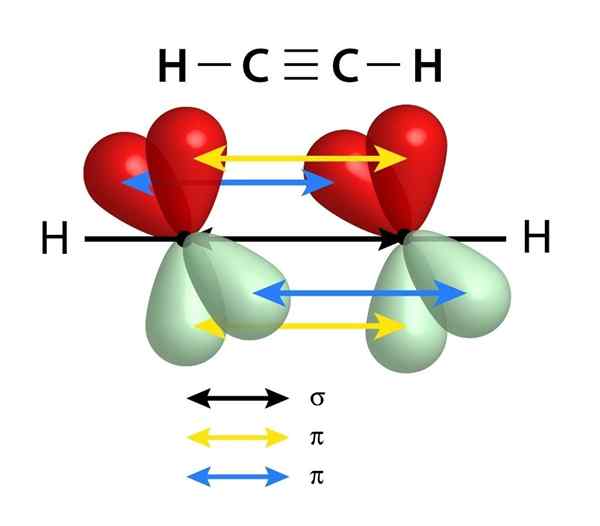 Schema van de links die een drievoudige link vormen tussen twee koolstofatomen. De zwarte pijl van het midden vertegenwoordigt de Sigma -link, terwijl het geel en het blauw elk van de twee PI -bindingen vertegenwoordigen
Schema van de links die een drievoudige link vormen tussen twee koolstofatomen. De zwarte pijl van het midden vertegenwoordigt de Sigma -link, terwijl het geel en het blauw elk van de twee PI -bindingen vertegenwoordigen Vergelijkbaar met dubbele bindingen, worden drievoudige links ook gevormd door een Sigma -link die door het midden van de lijn gaat die zich aansluit bij de twee gekoppelde atomen. In tegenstelling tot de dubbele links die er één hebben, hebben de drievoudige links echter twee PI -links naast de Sigma -link.
Kan u van dienst zijn: koperchloride (i) (CUCL): structuur, eigenschappen, gebruikZe vormen bijna altijd lineaire verbindingen
Wanneer twee koolstofatomen een drievoudige link vormen, heeft elk nog steeds de mogelijkheid om een extra eenvoudige link te vormen met een ander atoom (omdat koolstof in totaal 4 bindingen kan vormen).
In deze gevallen zullen zowel de twee koolstofatomen als de andere twee atomen die eraan zijn bevestigd, een rechte lijn vormen. Deze vorm die het molecuul verwerft, wordt lineaire geometrie genoemd.
Ze zijn de sterkste covalente bindingen
Bij het vergelijken van de drievoudige verbanden tussen twee atomen met de dubbele en eenvoudige bindingen tussen diezelfde atomen, wordt waargenomen dat de drievoudige links altijd sterker zijn dan de andere soorten covalente binding. Dit betekent dat het moeilijker is om een drievoudige link te breken dan een dubbele of eenvoudig.
Dit komt omdat bovendien de Sigma -link (die ook aanwezig is in zowel eenvoudige als dubbele bindingen), niet moet breken, niet één moet breken (zoals in dubbele links) maar twee extra PI -bindingen.
Ze zijn korter dan dubbele bindingen of dat eenvoudig
Vanwege hetzelfde feit dat ze sterkere links zijn, beheren Triple Links.
Ze vertegenwoordigen twee onverzadiging
Elke koolstof met een drievoudige binding heeft slechts een extra link met een ander atoom. Dit betekent dat dergelijke koolstof alleen zou worden gekoppeld aan twee atomen, in plaats van vier, dus het heeft minder waterstof dan het zou kunnen bezitten als het alleen eenvoudige bindingen zou vormen.
Kan u van dienst zijn: heptano (c7h16): structuur, eigenschappen en gebruikDit wordt onverzadiging genoemd en verbindingen met drievoudige links hebben twee onverzadiging, omdat elk van de twee koolstofatomen 2 extra hydrogenen zou passen, zo niet voor de drievoudige link.
Het zijn rigide links
Net als dubbele bindingen zijn drievoudige links rigide en moeilijk te buigen of te draaien. Dit komt door zowel de grotere bindingskracht als op de laagste lengte.
Ze kunnen als bases fungeren
Sommige verbindingen met drievoudige links kunnen de PI -elektronen van genoemde link gebruiken om H -ionen te koppelen of te accepteren+, Daarom fungeren als bases.
Ze kunnen ze waterstof waterstof geven om dubbele of eenvoudige links te geven
De onverzadiging van de drievoudige link kan worden verwijderd door de PI -bindingen te verbreken en hydrogenen toe te voegen aan de twee koolstofatomen. Dit wordt hydrogenering genoemd. Als alleen een waterstofmolecuul aan een drievoudige binding wordt toegevoegd, wordt het een dubbele binding. Als twee waterstofmoleculen worden toegevoegd, wordt dit een eenvoudige binding.
Voorbeelden van drievoudige covalente links
Stikstofmolecuul (n2))
Het stikstofmolecuul bevat een drievoudige covalente binding tussen de twee stikstofatomen. Elk atoom deelt zijn drie valentie -elektronen verdwenen met de andere, en elk nieuw paar elektronen wordt de Sigma -binding of een van de twee PI -bindingen die het molecuul bezit.
 Stikstofmolecuul
Stikstofmolecuul In dit geval, zowel de twee stikstofatomen als de ongedeerde elektronenparen die elk van hen zich langs een rechte lijn bevinden.
De juiste (een alkyne van formule C3H4))
De juiste is de tweede eenvoudigste alkyne die bestaat. Deze verbinding bestaat uit een ketting met drie carbon, waarvan er twee zijn gekoppeld via een drievoudige covalente link.
Kan u van dienst zijn: onverzadigde koolwaterstoffen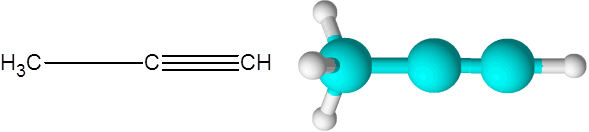 Propino -molecuul
Propino -molecuul Hier kunt u ook zien dat de drie koolstofatomen en het laatste waterstofatoom (die aan de rechterkant) een rechte lijn vormen. In het model is ook te zien dat de eenvoudige C-C-link langer is dan de drievoudige C-C-link.
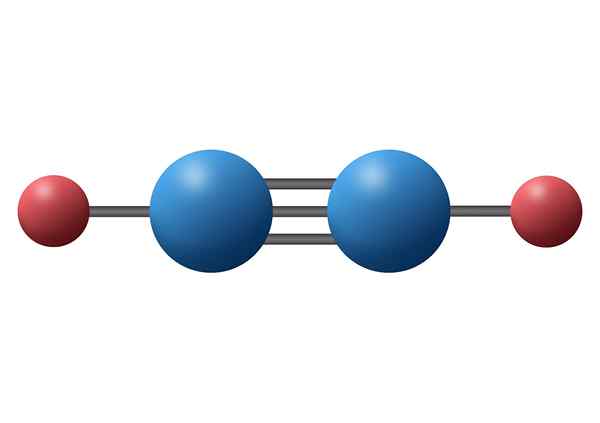
Koolmonoxide (CO)
Koolmonoxide is een giftig anorganisch gas met een negatief koolstofatoom en positieve zuurstof gekoppeld door een drievoudige covalente binding. In dit geval is het een polaire binding, vanwege het verschil in elektronegativiteiten tussen koolstof en zuurstof.
 Koolmonoxidemolecuul
Koolmonoxidemolecuul

