Covalente binding
- 3036
- 848
- Pete Heaney V
Wat is een covalente link?
De covalente binding is een sterke interactie waarmee twee of meer atomen zich kunnen aansluiten om moleculen te vormen. Dit is een van de soorten chemische bindingen waaraan een paar elektronen deelnemen die afkomstig zijn van de buitenste orbitalen van de atomen die zijn gekoppeld.
In theorie draagt elk atoom een van de twee elektronen bij wanneer ze covalent koppelen, zodat ze stabiliteit winnen. Het paar elektronen, dat een soort "elektronische haak" wordt tussen de twee atoomkernen, wordt gelijk gedeeld tussen twee identieke atomen, maar dit gebeurt niet wanneer de twee atomen van twee verschillende elementen zijn.
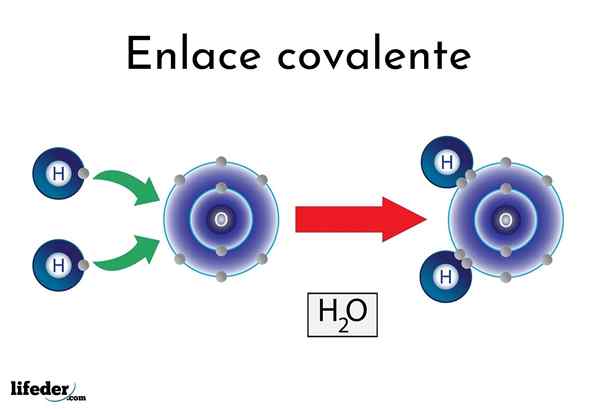
 Watercovalente binding
Watercovalente binding Er zijn atomen of elementen die een natuurlijke neiging hebben om elektronen op te leveren, terwijl anderen ze liever winnen.
Bijvoorbeeld het beroemde watermolecuul, h2Of het heeft twee covalente links: h-o-h. Hydrogenen en zuurstof delen de twee paren elektronen, maar deze baan dichter bij het zuurstofatoom dan waterstof. Dit fenomeen is te wijten aan polariteit en elektronegativiteit.
Kenmerken van covalente bindingen
De covalente bindingen vormen de volgende kenmerken:
-Ze omvatten een paar elektronen voor elke covalente binding.
-De lengtes worden meestal uitgedrukt in PM (picometers) of Armstrong (Å) -eenheden.
-Ze zijn moeilijk te breken, wat betekent dat ze erg sterk zijn.
-Wanneer ze breken, treden chemische veranderingen of transformaties op, omdat het molecuul atomen verliest. In dit proces wordt energie geabsorbeerd.
-Wanneer ze zich vormen, wordt een nieuw molecuul geboren. In dit proces wordt energie vrijgegeven.
Kan u van dienst zijn: chemische reacties: kenmerken, onderdelen, typen, voorbeelden-De lengtes variëren afhankelijk van de aviditeit die een van de gekoppelde atomen heeft ten opzichte van het paar elektronen; Dat wil zeggen, hoe meer het het aantrekt, de covalente link wordt verlengd.
-De eenvoudigste covalente bindingen bestaan alleen tussen twee atomen tegelijkertijd en worden weergegeven met een script of regel (-).
Er zijn andere functies die aanvragen voor complexere covalente links, die echter ook voldoen aan wat hierboven wordt becommentarieerd.
Soorten covalente links
De covalente bindingen kunnen in principe op twee manieren worden geclassificeerd: volgens het aantal gedeeld elektronen, en volgens de resulterende polariteit wanneer het molecuul wordt gevormd. Beide zullen hieronder oppervlakkig worden beschreven.
Volgens het aantal gedeelde elektronen
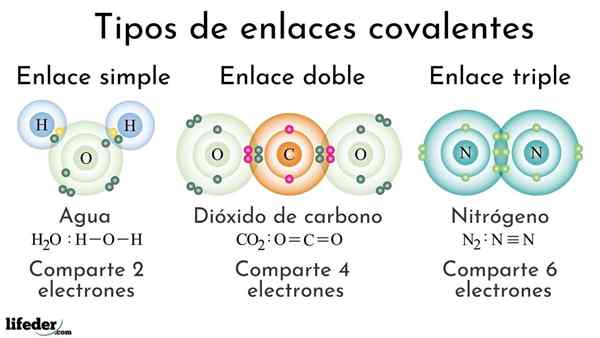 Soorten covalente bindingen volgens het aantal gedeelde elektronen
Soorten covalente bindingen volgens het aantal gedeelde elektronen Covalente bindingen volgens het aantal gedeelde elektronen kunnen worden geclassificeerd als eenvoudig, dubbel of drievoudig. In het bovenste beeld worden deze respectieve links voor drie moleculen die hieronder worden besproken getoond.
-
Eenvoudig
De eenvoudige covalente binding is er een waarin er slechts een paar elektronen zijn, dat wil zeggen twee elektronen. Een voorbeeld van deze link die we zien in het watermolecuul, h2OF. Merk op dat van alle covalente bindingen, de eenvoudige, i-i, de langste van allemaal is. Dit is bijna altijd.
-
Dubbele
In de dubbele covalente binding hebben we, zoals de naam al aangeeft, twee paar elektronen, wat betekent dat er vier elektronen zijn die de "elektronische haak" tussen de twee gekoppelde atomen versterken.
Dat wil zeggen, een dubbele binding (=) is sterker dan een eenvoudige (-). Het is echter reactiever, wat hoewel het misschien tegenstrijdig lijkt, gemakkelijk uit te leggen is, gezien de overlap van atomaire orbitalen.
Kan u van dienst zijn: polariteit (chemie): wat is, definitie, voorbeeldenEen voorbeeld van deze link is te zien in het koolstofdioxidemolecuul, CO2. De twee zuurstofatomen blijven sterk verenigd met koolstof dankzij deze binding, of = C = O, die, voor sterker, dichter bij atomen; En op zijn beurt leidt dit ertoe dat de link wordt ingekort.
-
Verdrievoudigen
De drievoudige link is de sterkste en kortste covalente bindingen (gewoon). Merk op dat voor het stikstofmolecuul, n2 of n≡N, hun atomen vertegenwoordigd door blauwachtige bollen liggen heel dicht bij elkaar.
In de drievoudige link hebben we drie elektronenparen, die gelijk zijn aan zes elektronen die de covalente binding tussen de twee atomen versterken.
-
Datief
De dative link is een speciaal type eenvoudige link die in het paar elektronen bestaat, komt alleen van een van de twee gekoppelde atomen. Dat wil zeggen, het kan worden gezien als een "gedwongen delen".
Bijvoorbeeld het M -molecuul2Of gebruik een van de zuurstofvrije paren om ze te doneren aan een ion h+ (H2O: → H+ = [H2OH]+ of h3OF+)).
Volgens polariteit
Covalente bindingen volgens polariteit kunnen worden geclassificeerd als polaire covalente of niet -polaire covalenten.
-
Polaire covalente bindingen
Het komt voor tussen twee verschillende atomen waarvan het verschil in elektronegativiteit groot is. Dit resulteert in de vorming van een dipool, waarbij een atoom zich negatief concentreert (trekt elektronen aan), terwijl de andere zich positief concentreert (levert elektronen op). De HF (HF) covalente binding is bijvoorbeeld polair, omdat fluoride elektronegatiefer is dan waterstof.
-
Niet -polaire covalente links
Het komt voor tussen twee identieke atomen waarvan het verschil in elektronegativiteit nul of erg klein is. De hierboven genoemde moleculen: i2, OF2 en N2 Ze presenteren niet -polaire covalente bindingen. Daarom zijn elektronen rond beide atomen met dezelfde frequentie.
Het kan u van dienst zijn: urethaan: structuur, eigenschappen, verkrijgen, gebruikVoorbeelden van covalente links
Ten slotte zullen andere covalente obligaties worden vermeld naast die al uitgelegd, wat ook hun typen aangeeft:
H2S (H-S-H), Simple Polar Covalent | HCL (H-Cl), Polar Simple Covalent Link |
H2 (H-H), niet Polar Simple Covalent | C2H4 (H-C≡C-H), met twee eenvoudige polaire links (C-H) en een drievoudige niet-polaire link (C≡C) |
F2 (F-F), eenvoudige niet-polaire covalent | P2 (P≡P), niet -polaire (of apolaire) covalente binding |
Co₂ (o = c = o), dubbele polaire covalent | S2 (s = s), niet -polaire dubbele covalente binding |
HCN (H-C≡N), met een eenvoudige polaire covalente binding (H-C) en een andere drievoudige polaire link (C≡N) | NH3 (N-H), met drie eenvoudige polaire covalente bindingen |
De geciteerde voorbeelden komen overeen met kleine moleculen. Maar covalente bindingen zijn aanwezig in alle bestaande moleculen, inclusief polymeren, biomoleculen, macromoleculen, mineralen, keramiek, koolwaterstoffen, onder vele anderen.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- María Estela Raffino. (28 juni 2020). Covalente binding. Concept.van. Hersteld van: concept.van
- Wikipedia. (2020). Covalente binding. Opgehaald uit: in.Wikipedia.borg
- Camy Fung & Nima Mirzaee. (15 augustus 2020). Covalente bindingen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Helmestine, Anne Marie, pH.D. (27 augustus 2020). Wat is een covalente binding in chemie? Hersteld van: Thoughtco.com

