Interne energie

- 1892
- 234
- Alton D'Amore
We leggen uit wat interne energie is, de functie ervan, hoe deze te berekenen en verschillende voorbeelden te geven
 Diagram met bijdragen aan de interne energie van een systeem. Bron: f. Zapata
Diagram met bijdragen aan de interne energie van een systeem. Bron: f. Zapata Wat is interne energie?
De interne energie Uit een object komt van de willekeurige beweging die de atomen en moleculen die het vormen hebben. Zelfs wanneer het object perfect in rust, binnenin, op microscopisch niveau is, bewegen de deeltjes die het samenstellen continu zonder rust.
Omdat deze deeltjes bewegen, hebben ze kinetische energie, die deel uitmaakt van hun interne energie. De andere bijdrage aan interne energie is de potentiële energie die voortkomt uit intermoleculaire krachten, verantwoordelijk voor het handhaven van de cohesie van de stof.
Deze intermoleculaire krachten zijn meestal van elektromagnetische oorsprong, maar zwaartekrachten en nucleaire krachten nemen ook deel.
Nu, afhankelijk van het type beweging van deeltjes, kan kinetische energie zijn:
- Vertaalbaar
- Trilling
- Roterend
De temperatuur meet alleen de translationele kinetische energie van de deeltjes. In principe zal de interne energie bij grotere temperatuur groter zijn, maar dit hangt ook af van de massa. A voorbeeld Het probleem verduidelijkt: een glas met warm water heeft minder interne energie dan een meer bij kamertemperatuur, hoewel de temperatuur van het glas hoger is, en dat komt omdat er meer water in het meer is dan in het glas.
In elk geval is de interne energie van een stof niet in beeld, deze hangt niet af van zijn beweging, noch hangt het af van zijn relatieve positie ten opzichte van andere objecten. De interne energie van een glas met water bij kamertemperatuur is bijvoorbeeld hetzelfde als het glas op een tafel ligt of als het op de vloer ligt.
Kan u van dienst zijn: niet -Coplanar -vectoren: definitie, voorwaarden, oefeningenInterne energiefunctie
Interne energie, die meestal wordt aangeduid als u, is een functie die afhankelijk is van de thermodynamische variabelen van het systeem, zoals temperatuur T en volume V. Daarom kan het wiskundig worden uitgedrukt als:
U = u (t, v)
In werkelijkheid is de absolute waarde van de interne energie van een systeem niet relevant, het gaat erom de variatie is, die wordt aangeduid met de Griekse letter δ ("delta"):
Δu = u voorletter - OF laatste
Nu kan interne energie worden gevarieerd als warmte wordt toegevoegd of geëxtraheerd. Warmte toevoegen Het is mogelijk dat het systeem een bepaald werk doet, zoals een zuiger in de cilinder van een motor.
De eerste wet van de thermodynamica
Uit de eerste wet van de thermodynamica is dat vastgesteld De variatie van interne energie Van een systeem equivalent aan:
Δu = q - w
Waar wat de hoeveelheid warmte is die naar het systeem wordt overgebracht en W is het werk dat het systeem doet, voor het geval het een aantal uitvoert. Alles wordt gemeten in joules in het internationale systeem van eenheden.
Als het systeem niet werkt, wordt de geleverde warmte in zijn geheel gebruikt om de interne energie van het systeem te vergroten.
Het volgende volgt uit de vorige uitdrukking:
- Δu> 0 betekent dat het systeem zijn interne energie verhoogt
- AU < 0 la energía interna del sistema disminuye
- Q> 0 Het systeem absorbeert warmte
- W> 0 Het systeem werkt.
Hoe interne energie te berekenen?
Het monoatomische ideale gas
In het monoatomische ideale gasmodel (een enkel atoom) interageren deeltjes niet met elkaar, zodat translationele kinetische energie de enige bijdrage is aan interne energie of gas. Er is een stelling, genoemd Equiparition stelling, die stelt dat elke mate van vrijheid een energie heeft die gelijk is aan:
Het kan u van dienst zijn: WAVE DIFFRAFTIE: Concept en voorbeeldenWaarbij t de temperatuur is en R de constante is van de ideale gassen, waarvan de waarde in eenheden van het internationale systeem is:
8.314472 J/mol ∙ kk
Een mate van vrijheid vertegenwoordigt de mogelijkheid om een bepaalde richting in de ruimte te bewegen. Een ideaal gasdeeltje kan in de drie richtingen van de ruimte bewegen, daarom is de energie van n mol gas:
Hoeveelheid warmte
Ervan uitgaande dat warmte wordt toegevoegd aan een systeem en dit werkt niet, wordt deze warmte alleen gebruikt om de interne energie van het systeem te vergroten. De hoeveelheid warmte die evenredig moet zijn met de massa M van het systeem en de temperatuurverandering:
Q ∝ m⋅δt
De evenredigheidsconstante hangt af van de stof en wordt genoemd specifieke hitte. De hitte roept C naar deze constante, is:
Q = mc⋅δt
Omdat warmte wordt omgekeerd bij het vergroten van de interne energie:
Q = mc⋅δt = Δu
Δu komt overeen met de variatie In interne energie.
Voorbeelden van interne energie
1. Temperatuur schommelingen
Veranderingen in de temperatuur van de stoffen genereren op hun beurt veranderingen in hun interne energie. Dit is wat er bijvoorbeeld gebeurt tijdens het koken. Door voedsel te verwarmen, neemt de agitatie van zijn moleculen toe, neemt de kinetische energie toe en doet daarom zijn interne energie.
2. Interne energie van twee stoffen bij dezelfde temperatuur
Twee stoffen bij dezelfde temperatuur hebben niet noodzakelijkerwijs dezelfde interne energie, omdat het afhankelijk is van twee bijdragen: kinetische energie en potentiële energie.
Als de stoffen op dezelfde temperatuur zijn, kan worden bevestigd dat de translationele kinetische energie van zijn deeltjes hetzelfde is, maar de potentiële energie is anders, omdat dit afhangt van de configuratie van de samenstellende atomen.
Kan u van dienst zijn: Hydrostatische druk: formule, berekening, voorbeelden, oefeningen3. Thermische expansie
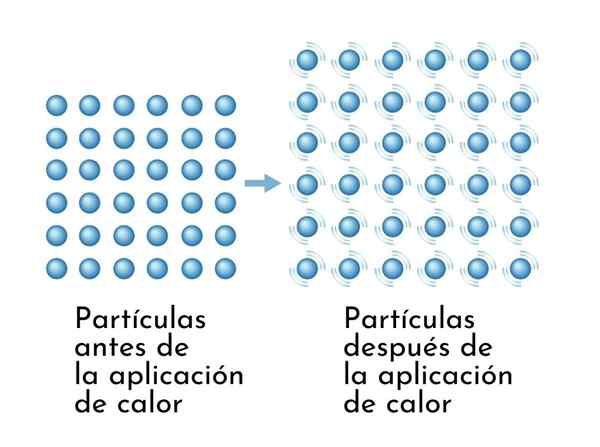 Stoffen groeien uit wanneer het wordt verwarmd, omdat de toename van interne energie ervoor zorgt dat hun deeltjes breder trillen, zodat de dimensies toenemen
Stoffen groeien uit wanneer het wordt verwarmd, omdat de toename van interne energie ervoor zorgt dat hun deeltjes breder trillen, zodat de dimensies toenemen Een zichtbaar gevolg van verwarmingsstoffen is de toename van hun dimensies, omdat de gemiddelde afstand tussen de atomen toeneemt.
Intermoleculaire krachten kunnen worden gesimuleerd door veren die een atoom verenigen.
4. Gecomprimeerde gassen
Gecomprimeerde gassen kunnen interne energie opslaan, omdat hun dichtheid toeneemt door het volume te verminderen en daarmee zijn interacties met de wanden van de containercontainer. Op deze manier kan een gecomprimeerd gas een klus doen, zoals het verplaatsen van een zuiger.
5. Batterijen
In een batterij treden chemische reacties op in staat om een elektrische stroom te genereren zodra het circuit wordt gesloten. Deze chemische potentiële energie wordt beschouwd als onderdeel van de interne energie van het systeem.
6. Systeem dat warmte absorbeert en werkt
Wanneer een systeem warmte absorbeert, verhoogt het zijn interne energie. Maar als hij tegelijkertijd werk doet, kan de eerste wet van de thermodynamica worden gebruikt om te weten hoeveel interne energie verandert. Aangenomen dat een systeem bijvoorbeeld 175 J warmte absorbeert en een taak uitvoert die gelijkwaardig is aan 62 J, is de verandering in zijn interne energie:
Δu = q - w = 175 j - 62 j = 113 j.



