Elektrodialysis hoe werkt, voor-, nadelen, gebruik
- 1805
- 109
- Irving McClure I
De Elektrodialyse Het is de ionenbeweging door een semipermeabiel membraan, aangedreven door een elektrisch potentiaalverschil. De membranen die in elektrodialyse worden gebruikt, hebben de eigenschap ionenwisselaars voor kationen of voor anionen.
Kationuitwisselingsmembranen hebben negatieve belastingen: ze laten kationen passeren en de anionen afstoten. Ondertussen hebben anionische uitwisselingsmembranen een positieve lading: ze laten de anionen en stoten kationen af.
 Schema van een pakket van vijf elektrodialysecellen. Bron: CommonShelper2 via Wikipedia.
Schema van een pakket van vijf elektrodialysecellen. Bron: CommonShelper2 via Wikipedia. Elektrodialysecamera's of cellen zijn georganiseerd in pakketten met verschillende anion- en kationische uitwisselingsmembranen, die met elkaar afwisselen. Anionische en kationische uitwisselingsmembranen afbakenen de ruimtes waar de verdunning- en concentratieprocessen van vloeistoffen worden uitgevoerd.
De drijvende kracht van ionische stromen die de membranen van elektrodialysecellen kruist, is een verschil in elektrische potentiaal tussen een kathode en een anode.
Ondertussen is in de omgekeerde osmose de waterstroom uit het compartiment met de grootste osmolariteit naar het lagere osmolariteitscompartiment te wijten aan een toename van de hydrostatische druk, veroorzaakt door de werking van een pomp.
[TOC]
Hoe werkt in waterdunning?
Beschrijving van een pakket van vijf elektrodialysecellen
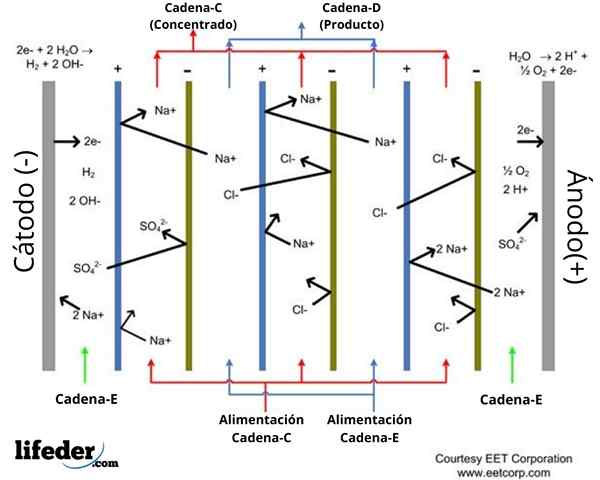
In het getoonde schema (superieure beeld) wordt de locatie van zes ionenuitwisselingsmembranen aangegeven: drie kationuitwisseling en drie anionuitwisseling, die met elkaar afgewisseld zijn. Deze membranen bedenken vijf compartimenten waar vloeistoffen die betrokken zijn bij elektrodialyse circuleren (zie rode en blauwachtige pijlen).
Anionische uitwisselingsmembranen worden positief geladen en verschijnen in het blauw -gekleurde schema. Deze laten de anionen passeren en de kationen afstoten voor elektrostatische afstoting.
De kationuitwisselingsmembranen hebben hoewel een negatieve belasting, die in het groene schema aangeven. Ze worden doorkruist door kationen, maar de anionen afstoten.
Het kan u van dienst zijn: Test: kenmerken, typen, voorbeelden van gebruikBeide soorten membranen zijn waterdicht voor water. Het schema toont twee ruimtes waar een verdunning van het zoutoplossing van het water optreedt. In het schema worden de waterige stroomstromen en uitgang van deze ruimtes aangegeven in blauw, geïdentificeerd als stroom d.
Ondertussen zijn er drie ruimtes waar water circuleert met een hoog zoutoplossing, dat rood wordt geïdentificeerd. Inkomsten- en exitstromen naar deze compartimenten worden in de regeling aangegeven als huidige C.
Evenzo worden de anode (+) en kathode (-) compartimenten aangegeven in het schema, waardoor de huidige en.
Electrodialysis -werking
De kationen worden aangetrokken door de belasting van de kathode (-), terwijl de anode (+) afgestoten is. De anionen worden aangetrokken door de belasting van de anode (+) en afgestoten door de belasting van de kathode (-).
De observatie, bijvoorbeeld van cellen drie, vier en vijf, geeft het volgende aan: in cellen drie en vijf circulaten geconcentreerde vloeistof, terwijl in cel vier vloeistof circuleert.
De ion cl- van compartiment vier wordt aangetrokken tot de belasting van de anode en kruist het anionische uitwisselingsmembraan dat het scheidt van compartiment vijf.
Ondertussen, het na ion+ van compartiment vijf wordt afgestoten door de positieve belasting van de anode, maar niet in staat om compartiment vier te betreden. Dit komt omdat het membraan dat compartimenten scheidt vier en vijf van anionische uitwisseling is, dus het stort kationen af.
Aan de andere kant, de NA+ van compartiment vier wordt afgestoten door de anode (+) en kruist het kationuitwisselingsmembraan (-) dat het scheidt van het compartiment drie.
Samenvattend: NA -concentratie+ en Cl- Vier compartiment neemt de neiging af. Vervolgens neemt de zoutoplossingconcentratie af in verdunningscompartimenten en neemt toe in concentratiecompartimenten.
Het kan u van dienst zijn: Applied Chemistry: Object of Study, Takken, Bang, voorbeeldenVoor-en nadelen
Voordelen
-Electrodialysis is een eenvoudige en continue werking.
-Chemische behandeling is niet vereist om uitwisselingsmembranen te regenereren.
-Er zijn lage bedrijfskosten en onderhoud, die weinig ruimte vereisen voor de werking ervan.
Nadelen
-Deeltjes met een diameter groter dan 1 µm kunnen ionenuitwisselingsmembranen belemmeren.
-Het wordt niet aanbevolen om water te gebruiken met een hardheid groter dan 1, omdat calciumcarbonaat een korst in concentraatcellen creëert.
-Vereist behandeling van koolstofdioxide -eliminatiebehandeling (CO2), omdat dit bij het dissociëren de watergeleidbaarheid kan wijzigen.
Verschil tussen dialyse en elektrodialyse
Dialyse is waterstroom door een semipermeable membraan van het kleinere osmolariteitscompartiment naar het grotere osmolariteitscompartiment. Het compartiment met minder osmolariteit heeft een grotere concentratie watermoleculen.
Om deze reden stroomt water, ten gunste van zijn concentratiegradiënt, van het compartiment met minder osmolariteit naar het compartiment met een grotere osmolariteit.
Electrodialysis daarentegen is een stroom van ionen door een ionenuitwisselingsmembraan dat al dan niet doorgaat naar ionen, afhankelijk van de elektrische lading. De drijvende kracht van ionenbeweging is een verschil in elektrisch potentieel.
In tegenstelling tot dialyse is er in elektrodialyse geen waterstroom door membranen en is er alleen ionenstroom.
Electrodialysis -toepassingen
Waterdemineralisatie
Er zijn elektrodialyseplanten die water verwerken met hoge zouten om drinkwater te produceren. Elektrodialysis wordt ook gebruikt om afvalwater te verwerken door binnenlands en industrieel gebruik, met als doel ze geschikt te maken voor het daaropvolgende verbruik.
Het kan u van dienst zijn: Erlenmeyer Flask: kenmerken, gebruik, gebruiksmethodenIn het bijzonder wordt elektrodialyse gebruikt bij het herstel van waardevolle metalen die aanwezig zijn in de effluentwateren van de industrie. Het wordt ook gebruikt bij het verwijderen van zouten en zure oplossingen, en bij de scheiding van ionische verbindingen van neutrale moleculen.
Voedselindustrie
Hoewel elektrodialyse wordt gebruikt in de farmaceutische industrie, in cosmetica, evenals in andere industrieën, is het meest voorkomende gebruik ervan in de voedingsindustrie. Onder al uw toepassingen kunnen we het volgende vermelden:
-Smineralisatie van serum en melasse
-Wijn wijnsteenzuurstabilisatie
-Afname van de zuurgraad van vruchtensappen
-Productie van groente -eiwitten geïsoleerd
-Falen van serumeiwitten
-Demineralisatie van soja- en visolie
-Eliminatie van bieten alkalische ionen en rietmelasse
-Behandeling van zeevruchtenafval
-Demineralisatie van druiven Must en aardappelsap
-Concentratie en herstel van organische zuren
-Soja -eiwitproductie
-Antioxidant verrijking
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Elektrodialyse. Opgehaald uit: in.Wikipedia.borg
- Lentech B.V. (2020). Wat is EDI? Hersteld van: Lentech.com
- Mondor m., Ippersiel D., Lamarche f. (2012) Elektrodialyse in voedselverwerking. In: Boye J., Arcand en. (eds) Groene technologieën in voedselproductie en -verwerking. Food Engineering Series. Springer, Boston, MA. doen.org/10.1007/978-1-4614-1587-9_12
- Akhter M, Habib G, Qamar His (2018) Toepassing van elektrodiasis in afvalwaterbehandeling en impact van vervuiling op procesprestaties. J Memb Sci Technol 8: 182. Doi: 10.4172/2155-9589.1000182
- H. Strathmann. (6 december 2006). Elektrodiasis en de toepassing ervan in de chemische procesindustrie. Taylor & Francis online. doen.org/10.1080/03602548508068411
- « Derde persoon opstellen van kenmerken en voorbeelden
- De 8 voorbeelden van de meest relevante grafische bronnen »

