Elektrofiele reacties, voorbeelden, elektrofiliciteit
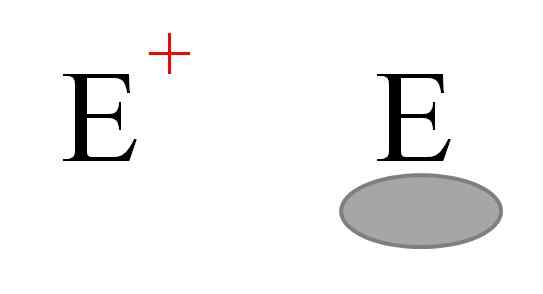
- 2238
- 262
- Glen Armstrong
A Elektrofiel Het is al die chemische soorten (atoom of molecuul) die er enthousiast uitziet in een paar elektronen. Het woord betekent 'liefde voor elektronen'. Daarom zal een elektrofie altijd de neiging hebben om elektronen te winnen of te accepteren bij deelname aan chemische reacties.
Wat maakt een elektrofiel die elektronen nodig heeft? U moet een elektroneficiëntie hebben, of het nu wordt gemanifesteerd door een gedeeltelijke of totale positieve belasting, of door een elektronisch leegstandsproduct van een onvolledig valentie -octet. Dat wil zeggen, we hebben verschillende soorten elektrofielen, hoewel ze allemaal paren van elektronen van negatieve soorten accepteren.
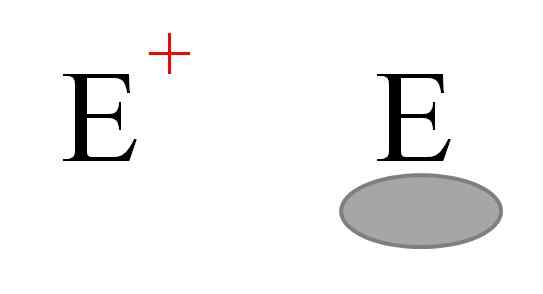 De twee meest voorkomende soorten elektrofielen in de chemie. Bron: Gabriel Bolívar.
De twee meest voorkomende soorten elektrofielen in de chemie. Bron: Gabriel Bolívar. Over het algemeen worden twee soorten elektrofielen weergegeven. Beide worden gesymboliseerd met de letter en. Degene aan de linkerkant komt overeen met een positieve lading -elektrofie, en+. Ondertussen komt degene aan de rechterkant overeen met een elektrofiel met elektronische vacature, weergegeven door een grijsachtig ovaal dat de afwezigheid van elektronen aangeeft in een orbitaal van Valencia.
Metaalkationen zijn voorbeelden van elektrofielen en+, evenals sommige polyiatomische ionen zoals hydronium, h3OF+. ALH's moleculen3 en BF3, Aan de andere kant zijn het voorbeelden van het tweede type elektrofielen, omdat zowel het aluminium als het booratoom een elektroneficiëntie hebben omdat ze het octet van Valencia niet voltooien.
[TOC]
Reacties
Elektrofielen reageren het accepteren van atoomelektronenparen met hoge negatieve dichtheden, dat wil zeggen elektronenrijk. Deze negatieve atomen of moleculen worden nucleofielen genoemd, nu-, die een paar elektronen doneren aan de elektrofie en e e+:
Wildebeest- + EN+ → Nu-E
Dit is de theoretische basis voor veel organische reacties, zoals aromatische elektrofiele substitutie. De nucleofiel hoeft niet noodzakelijk een anion te zijn, maar het kan ook een neutraal molecuul zijn met een elektronegatief atoom, zoals stikstof.
Kan u van dienst zijn: silicium: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikVoorbeelden van elektrofielen
Lewis -zuren
Lewis -zuren zijn elektrofielen, omdat ze per definitie elektronenparen accepteren. Metalen kationen, mN+, Trek de negatieve gebieden van de omliggende polaire moleculen aan in de solvatieprocessen. Dus mN+ uiteindelijk omringende negatieve belastingen, zelfs om elektronen te accepteren om coördinatiecomplexen te vormen.
De kom Cu2+, Het is bijvoorbeeld een Lewis -zuur en een elektrofiel omdat het wordt gecoördineerd met waterzuurstofatomen om een complexe ACU te vormen2))62+. Op dezelfde manier gebeurt het met andere kationen.
Niet alle Lewis -zuren zijn kationen: sommige zijn neutrale moleculen of atomen. Bijvoorbeeld de BF3 Het is een Lewis -zuur en een elektrofiel omdat.
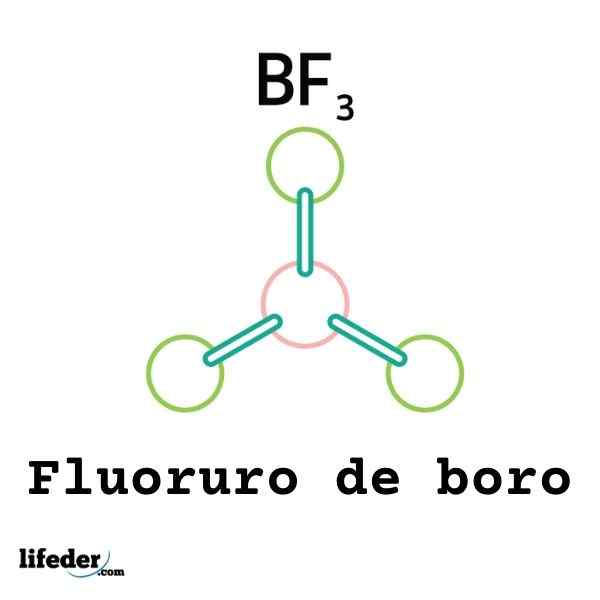
Het zal dus gekoppeld zijn aan een omliggende fluoride -anion om het Boro Tetrafluoruro Anion, BF te vormen4-. Dat wil zeggen de BF3 vormt een link met de F- door een paar van hun elektronen te accepteren.
Een andere elektrofie is nitronio -ion, nee2+, wat een is Elektrofylisch middel Zeer sterk gevormd in de nitratiereacties van benzeen. In dat ion heeft het stikstofatoom een positieve belasting, dus de benzeenelektronen accepteren snel.
Brönsted zuren
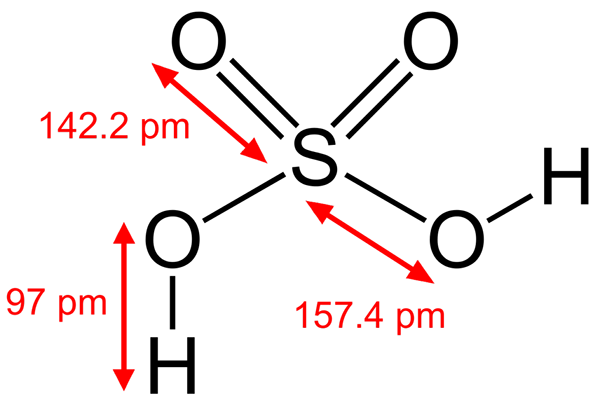 Zwavelzuurstructuur
Zwavelzuurstructuur Sommige Brönsted -zuren zijn ook elektrofielen. Bijvoorbeeld het hydroniumkation, h3OF+, Het is een elektrofiel omdat het zuurstofatoom een positieve belasting heeft. Omdat je erg elektronegatief bent, zul je proberen elektronen te krijgen die een van zijn hydrogenen doneren om te transformeren in een watermolecuul.
Nog een brönsted zuur zoals zwavelzuur, h2SW4, Het is ook een elektrofiel. Het zwavelatoom is sterk geoxideerd en zal proberen elektronen te krijgen die zijn twee hydrogenen doneert.
Kan u van dienst zijn: koolstoftetrachloride (CCL4)Halogenen
Halogenen (f2, Klet2, BR2 en ik2) Het zijn elektrofielen. De atomen hebben geen elektronische tekortkomingen; Hun links zijn echter onstabiel, omdat beide atomen, X-X, zeer sterk elektronen aantrekken.
Daarom reageren halogenen als oxidatiemiddelen, gedragen zich als elektrofielen en accepteren ze elektronenparen om halogenide -anionen te worden (f-, Klet-, BR- en ik-)).
Halogenen winnen echter niet alleen op deze manier elektronen. Ze kunnen ook worden gekoppeld aan minder elektronegatieve atomen dan zij om een netto elektronenwinst te verkrijgen. Dit is bijvoorbeeld de reden waarom ze kunnen worden toegevoegd aan de dubbele bindingen van alkenes of olefines.
Halogenen vertegenwoordigen een ander type elektrofie dan de twee die in het begin werden geïntroduceerd. Het gedrag aan het einde is echter hetzelfde als voor alle elektrofielen: accepteer elektronenparen.
Huur- en waterstofhalogeniden
 CFC -moleculen zijn alkylhalogeniden
CFC -moleculen zijn alkylhalogeniden Huur- en waterstofhalogeniden zijn elektrofielen waarbij halogeen gekoppeld atoom een sterk elektronisch deficiëntie heeft dat wordt weergegeven door het 8 -symbool+. Dit komt omdat het halogeen, zeer elektronegatief, de elektronische dichtheid van het naburige atoom voor zichzelf aantrekt.
Voor alkylhalogeniden zal Rx, R een elektronisch tekort hebben, terwijl x overtollige elektronen, rδ+-Xδ-. Dus als een zeer negatieve soort RX nadert, zal het R aanvallen om ermee te koppelen en X als een anion te laten komen.
In waterstofhalogeniden heeft HX ook waterstof een elektronisch tekort of een positieve gedeeltelijke belasting, hδ+-Xδ-. Daarom zullen negatieve soorten hun elektronen aan deze waterstof overbrengen en hij als elektrofiel zal ze accepteren.
Carbonylverbindingen
Zuren, halogenen en halogeniden zijn niet de enige moleculen die kunnen worden geclassificeerd als elektrofielen. Zelfs zo niet, koolstofdioxide, co2, Het is een elektrofiel, omdat het centrale koolstofatoom zeer geoxideerd is, of = cδ+= O.
Kan u van dienst zijn: vlakke achtergrondflesDaarom, wanneer CO -2 Reacta zal het doen dat elektronenparen accepteren, hetzij de carboxylaat, COOH -groep, of de carbonaatanion, CO worden32-.
Naast CO2, Carbonylverbindingen, zoals ketonen, aldehyden en esters zijn ook voorbeelden van elektrofielen, omdat koolstof in een positieve gedeeltelijke belasting heeft en de neiging heeft elektronen van zeer negatieve soorten te accepteren.
Carbocaties
 Methaan koolstofatoom positief geladen
Methaan koolstofatoom positief geladen Carbocaties zijn buitengewoon sterke Lewis -zuren. Er zijn tertiair (r3C+), secundair (r2HC+) of primaire (RH2C+)). Koolstof vormt altijd vier bindingen, dus dit kation zal met name proberen hoe elektronen op welke manier dan ook te accepteren.
Elektrofiliciteit
Niet alle elektrofielen zijn net zo "hongerig" door elektronen. Sommige zijn meer reactief dan andere. Hoe groter het elektronische elektrofielgebrek, hoe groter de gevoeligheid ervan om nucleofiele aanvallen van negatieve soorten te ondergaan. Dat wil zeggen, het zal een grotere elektrofyliteit vertonen, wat de relatieve maat is voor hoe reactief de elektrofiel in kwestie is.
Carbocaties, nitronium en fluoride hebben bijvoorbeeld een hoge elektrofylaity; Terwijl koolstofdioxide of sommige kationen zoals natrium lage elektrofylacatie hebben.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Elektrofiel. Opgehaald uit: in.Wikipedia.borg
- James Ashenhurst. (2020). Nucleofielen en elektrofielen. Hersteld van: MasterGanicChemistry.com
- Professor Patricia Shaley. (2012). Nucleofielen en elektrofielen. Universiteit van Illinois. Hersteld van: Butane.Chem.Uiuc.Edu
- Danielle Reid. (2020). Elektrofiel: definitie en voorbeeld. Studie. Hersteld van: studie.com
- Tim Soderberg. (7 oktober 2019). Elektrofielen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- « Biot-Savart Law-formule, demonstratie, toepassingen, oefeningen
- De tolerantiewet van Shelford wat bestaat en voorbeelden »

