Chemische deelbaarheid
- 4024
- 871
- Irving McClure I
 Transformatie van materie, een voorbeeld van deelbaarheid in chemie. Bron: Mikerun, CC BY-SA 4.0, Wikimedia Commons
Transformatie van materie, een voorbeeld van deelbaarheid in chemie. Bron: Mikerun, CC BY-SA 4.0, Wikimedia Commons Wat is chemische deelbaarheid?
We kunnen de Chemische deelbaarheid Als een eigenschap van materie waarmee u in kleinere porties kunt scheiden. Om het concept te begrijpen, kunnen we een voorbeeld geven.
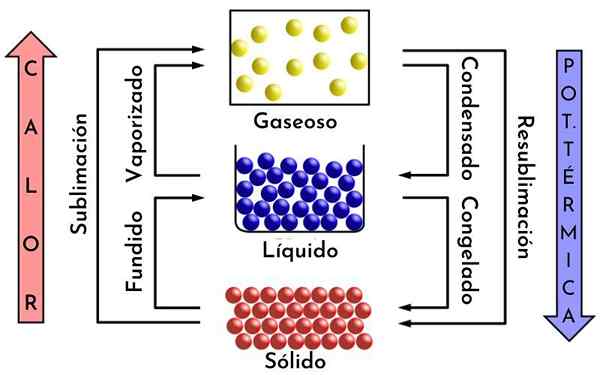
Als een ijsblokje wordt gesmolten, wordt deze water en wanneer deze wordt onderworpen aan warmte, wordt deze omgezet in stoom. Deze stoom kan op zijn beurt worden verdeeld in moleculen, en deze, in atomen.
Chemische deelbaarheid is dan de mogelijkheid van de kwestie van het delen in steeds kleine onderdelen.
Oorsprong en concept van chemische deelbaarheid
Lange tijd werd het besproken als de zaak bestond uit deeltjes (wat we vandaag als atomen kennen), het algemene idee was echter dat materie een continuüm was dat kon worden verdeeld.
Dit algemene concept maakte een slachtoffer van spot van briljante wetenschappers zoals James Clerk Maxwell (van Maxwell's Vergelijkingen) en Ludwig Boltzman (uit de verdeling van Boltzman) iets dat de eerste naar Madness en de tweede naar zelfmoord sleepte.
In de 5e eeuw.C., De Griekse filosoof Leucipo en zijn Democritus -discipel gebruikten het woord atoom om het kleinste individuele stukje materie aan te duiden, en stelde voor dat de wereld niet uit meer bestaat dan bewegende atomen.
Deze vroege atoomtheorie verschilde van latere versies, omdat het het idee omvatte van een menselijke ziel die bestond uit een meer verfijnd type van het atoom dat door het lichaam is verdeeld.
Atomische theorie raakte in de middeleeuwen in de daling, maar nieuw leven ingeblazen aan het begin van de wetenschappelijke revolutie in de zeventiende eeuw.
Isaac Newton geloofde bijvoorbeeld dat materie bestond uit "solide, massieve, harde, ondoordringbare en mobiele deeltjes".
Kan u van dienst zijn: Moleculaire formule: hoe u het uit kunt krijgen, voorbeelden en oefeningenDivisibiliteit kan door verschillende methoden worden gegeven: de meest voorkomende is deelbaarheid door fysieke methoden, zoals het hakken van een appel met een mes.
Dichtbaarheid kan echter ook worden gegeven door chemische methoden, waarbij materie zou worden gescheiden in moleculen of atomen.
Voorbeelden van chemische deelbaarheid
1. Los zout op
Wanneer een zout wordt opgelost, bijvoorbeeld natriumchloride, in water, treedt een solvatiefenomeen op waar de ionische zoutverbanden worden verbroken:
NaCl → NA+ + Klet-
Door alleen een korrel zout in water op te lossen, wordt het gescheiden in miljarden natrium- en chloride -ionen in oplossing.
2. Oxidatie van metalen in zuur medium
Alle metalen, bijvoorbeeld magnesium of zink, reageren met zuren, zoals verdund zoutzuur, om waterstofbellen en een kleurloze oplossing van metaalchloride te geven.
Mg + HCl → Mg2+ +Klet- + H2
Oxida tot metaalzuur door metaalbindingen te scheiden om ionen in oplossing te verkrijgen.
3. Esters hydrolyse
Hydrolyse is de breuk van een chemische binding door middel van water. Een voorbeeld van hydrolyse is de hydrolyse van esters, waarbij ze zijn verdeeld in twee moleculen, een alcohol en een carbonzuur.
4. Eliminatiereacties
Een eliminatiereactie doet precies wat het zegt: het elimineert de atomen van een molecuul. Dit wordt gedaan om een dubbele binding van koolstof koolstofarme te creëren. Dit kan worden gedaan met behulp van een basis of een zuur.
Het kan optreden in een enkele gecoördineerde stap (de abstractie van het proton in Ca dat tegelijkertijd plaatsvindt met de splitsing van de Cβ-X-link), of in twee stappen (de splitsing van de Cβ-X-link komt eerst voor om te vormen Een tussenliggende carbocatie, die vervolgens "uitschakelt" door de abstractie van het proton in de alfa-koolstof)).
Kan u van dienst zijn: darmstadtio: ontdekking, structuur, eigenschappen, gebruik5. Aldolase -enzymatische reactie
In de preparatieve fase van glycolyse wordt een glucosemolecuul verdeeld in twee glyceraldehyde moleculen 3-fosfaat (G3P) met behulp van 2 ATP.
Het enzym dat wordt beschuldigd van die incisie is de aldolase, die door een omgekeerde condensatie het 1,6-bifosfaatfructosemolecuul verdeelt in een G3P-molecuul en een dihydroxyacetonfosfaatmolecuul, dat vervolgens wordt gevormd om een andere molecuul van G3P te vormen.
6. Degradatie van biomoleculen
Niet alleen glycolyse, maar alle afbraak van biomoleculen in katabolisme -reacties zijn voorbeelden van chemische deelbaarheid.
Dit is te wijten aan het feit dat grote moleculen zoals koolhydraten, vetzuren en eiwitten kleinere moleculen produceren, zoals acetyl COA, die de Krebs -cyclus binnenkomen om energie te produceren in de vorm van ATP.
7. Verbrandingsreacties
Dit is een ander voorbeeld van chemische deelbaarheid, omdat complexe moleculen, zoals propaan of butaan, reageren met zuurstof om co₂ en water te produceren:
C3H8 + 5e2 → 3CO2 + 4h2OF
De afbraak van biomoleculen kan worden gezegd dat het een verbrandingsreactie is, omdat de eindproducten co₂ en water zijn, deze komen echter in veel stappen voor met verschillende tussenpersonen.
8. Bloedcentrifugatie
De scheiding van de verschillende bloedcomponenten is een voorbeeld van deelbaarheid. Ondanks dat het een fysiek proces is, is het voorbeeld interessant, omdat de componenten door dichtheidsverschil worden gescheiden door centrifugatie.
De dichtste componenten, het serum met de rode bloedcellen, blijven aan de onderkant van de centrifugebuis, terwijl de minder dichte, het plasma, in het bovenste deel blijft.
Kan u van dienst zijn: neutraal atoom9. Bicarbonaatbuffer
Natriumbicarbonaat, HCO3-, Het is de belangrijkste manier van transport van CO₂ in het lichaamsproduct van metabole afbraakreacties.
Deze verbinding reageert met een medium proton om koolzuur te produceren, dat vervolgens wordt verdeeld in co₂ en water:
HCO3- + H+ D H2CO3 D Co₂ + H₂o
Aangezien de reacties omkeerbaar zijn, is dit een manier die het lichaam door ademhaling heeft om de fysiologische pH te beheersen om alkalose- of acidose -processen te voorkomen.
10. Nucleair atoom- of splijtingsdivisie
In het geval dat een enorme kern (zoals uranium-235) wordt gebroken (fissies), zal leiden tot een netto energieprestaties. Dit komt omdat de som van de massa van de fragmenten minder zal zijn dan de massa van de uraniumkern.
In het geval dat de massa van de fragmenten gelijk is aan of groter dan die van ijzer in de piek van de linkergiecurve, zullen de nucleaire deeltjes nauwer verbonden zijn dan in de uraniumkern en die afnemen in massa -vorm in energievorm volgens met Einstein's vergelijking.
Voor elementen lichter dan ijzer, zal fusie energie produceren. Dit concept leidde tot het creëren van de atoombom en kernenergie.
Referenties
- Reacties van zuren. BBC is hersteld.co.Uk.
- Voist, l. (S.F.)). Eliminatiereacties in organische chemie. Studie hersteld.com.
- Kernfisatie (s.F.)). Hersteld van hyperfysica.

