Externe elektronische configuratie
- 4756
- 1482
- Lonnie Rohan
 Elektronische orbitalen. Bron: Patricia.Fidi, Wikimedia Commons
Elektronische orbitalen. Bron: Patricia.Fidi, Wikimedia Commons Wat is externe elektronische configuratie?
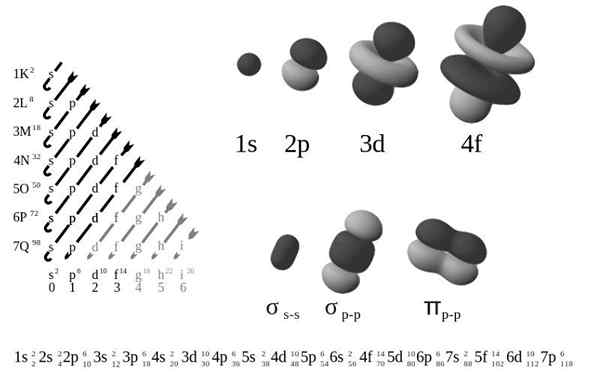
De Externe elektronische configuratie, Ook wel elektronische structuur genoemd, het is de opstelling van elektronen op niveaus en subniveau van energie rond een atoomkern. De niveaus zijn van 1 tot 7, en de subniveau zijn S, P, D en F.
Volgens het oude atoommodel van Bohr bezetten elektronen verschillende niveaus in banen rond de kern, van de eerste laag die het dichtst bij de kern, k, tot de zevende laag, q, de verste laag.
In termen van een meer verfijnd kwantummechanisch model, worden K-Q-lagen onderverdeeld in een set orbitalen, die elk door niet meer dan een paar elektronen kunnen worden bezet.
Gewoonlijk wordt elektronische configuratie gebruikt om de orbitalen van een atoom in zijn fundamentele staat te beschrijven, maar het kan ook worden gebruikt om een atoom weer te geven dat is geïoniseerd in een kation of anion, die het verlies of de winst van elektronen in hun respectieve orbitalen compenseert.
Veel van de fysische en chemische eigenschappen van de elementen kunnen worden gecorreleerd met hun unieke elektronische configuraties. Valencia -elektronen, elektronen in de buitenste laag, zijn de bepalende factor voor de unieke chemie van het element.
Basisconcepten van elektronische configuraties
Voordat u de elektronen van een atoom aan de orbitalen toewijst, moet men vertrouwd raken met de basisconcepten van elektronische configuraties. Elk element van het periodiek systeem bestaat uit atomen, die zijn samengesteld uit protonen, neutronen en elektronen.
De elektronen vertonen een negatieve belasting en zijn rond de kern van het atoom in de elektronenorbitalen, gedefinieerd als het volume van de ruimte waarin het elektron binnen 95% kan worden gevonden.
De vier verschillende soorten orbitalen (s, p, d en f) hebben verschillende manieren en een orbitaal kan maximaal twee elektronen bevatten. Orbitalen P, D en F hebben verschillende subniveau, zodat ze meer elektronen kunnen bevatten.
Kan u van dienst zijn: batchreactor: kenmerken, onderdelen, toepassingenZoals aangegeven, is de elektronische configuratie van elk element uniek voor zijn positie in het periodiek systeem. Het energieniveau wordt bepaald door de periode en het aantal elektronen wordt gegeven door het atoomnummer van het element.
Orbitalen op verschillende energieniveaus zijn vergelijkbaar met elkaar, maar bezetten verschillende gebieden in de ruimte.
De 1s orbital en de orbitale 2's hebben de kenmerken van een orbitale S (radioknooppunten, waarschijnlijkheden van bolvormig volume, kunnen slechts twee elektronen bevatten, enz.)). Maar zoals op verschillende niveaus van energie, bezetten ze verschillende ruimtes rond de kern. Elk orbitaal kan worden weergegeven door specifieke blokken in het periodiek systeem.
Het S -blok is het gebied van alkalische metalen, inclusief helium (groepen 1 en 2), blok D zijn overgangsmetalen (groepen 3 tot 12), blok P zijn de elementen van de hoofdgroep van groepen 13 a 18, en blok f zijn De reeks lantaniden en actiniden.
AUFBAU -principe
Aufbau komt uit het Duitse woord Aufbauen, Wat betekent "bouwt". In wezen, bij het schrijven van elektronenconfiguraties, bouwen we elektronenorbitalen terwijl we doorgaan van het ene atoom naar het andere.
Terwijl we de elektronische configuratie van een atoom schrijven, vullen we de orbitalen in toenemende volgorde van atoomnummer.
Het AUFBAU -principe is afkomstig van het uitsluitingsprincipe van Pauli, dat zegt dat er geen twee fermionen (bijvoorbeeld elektronen) in een atoom zijn. Ze kunnen dezelfde set kwantumaantallen hebben, dus ze moeten zich "accumuleren" op hogere energieniveaus.
De manier waarop elektronen zich ophopen, is een elektronenconfiguratieprobleem.
De stabiele atomen hebben zoveel elektronen als de protonen in de kern. De elektronen ontmoeten elkaar rond de kern in kwantumorbitalen, volgens vier basisregels genaamd AUFBAU -principe.
Kan u van dienst zijn: bariumchloride (BACL2)1. Er zijn geen twee elektronen in het atoom gedeeld door dezelfde vier kwantumnummers n, l, m en s.
2. Elektronen zullen eerst de orbitalen van het laagste energieniveau bezetten.
3. De elektronen vullen de orbitalen altijd met hetzelfde spinnummer. Wanneer de orbitalen vol zijn, begint deze.
4. Elektronen vullen orbitalen voor de som van kwantumnummers n en l. Orbitalen met gelijke waarden (n + l) worden eerst gevuld met lagere n waarden.
De tweede en vierde regels zijn in principe hetzelfde. Een voorbeeld van regel vier zou orbitalen 2p en 3s zijn.
Een orbitale 2p is n = 2 en l = 2 en een 3s orbitaal is n = 3 en l = 1. (N + l) = 4 in beide gevallen, maar het 2p orbitaal heeft de laagste energie of lagere waarde en wordt vóór laag 3s gevuld.
Gelukkig kunt u het getoonde Moeller -diagram gebruiken om elektronen te vullen. De grafiek wordt gelezen door de diagonalen uit 1s uit te voeren.
 Moorler -diagram. Bron: Gabriel Bolívar
Moorler -diagram. Bron: Gabriel Bolívar Nu het bekend is dat de volgorde van de orbitalen is gevuld, is het enige dat overblijft, het onthouden van de grootte van elk orbitaal.
Orbitalen hebben 1 mogelijke waarde van ml Om 2 elektronen te bevatten
P -orbitalen hebben 3 mogelijke waarden van Ml Om 6 elektronen te bevatten
Orbitalen hebben 5 mogelijke waarden van ml Om 10 elektronen te bevatten
F orbitalen hebben 7 mogelijke waardenl Om 14 elektronen te bevatten
Dit is alles wat nodig is om de elektronische configuratie van een stabiel atoom van een element te bepalen.
Neem bijvoorbeeld het stikstofelement. Stikstof heeft zeven protonen en daarom zeven elektronen. De eerste orbitale om te vullen zijn de orbitale 1s.
Een orbitale S heeft twee elektronen, dus er zijn nog vijf elektronen over. De volgende orbital is de 2s orbital en bevat de volgende twee. De drie laatste elektronen gaan naar de 2p orbital die maximaal zes elektronen kan bevatten.
Kan u van dienst zijn: carboxymethylcelluloseBelang van externe elektronische configuratie
Elektronenconfiguraties spelen een belangrijke rol bij het bepalen van atoomeigenschappen.
Alle atomen van dezelfde groep hebben dezelfde externe elektronische configuratie met uitzondering van het atoomnummer N, daarom hebben ze vergelijkbare chemische eigenschappen.
Sommige van de belangrijkste factoren die de atomaire eigenschappen beïnvloeden, zijn de grootte van de grootste bezette orbitalen, de energie van de meeste energieorbitalen, het aantal orbitale vacatures en het aantal elektronen in de orbitalen van grotere energie.
De meeste atomaire eigenschappen kunnen gerelateerd zijn aan de mate van aantrekking tussen de elektronen die extern zijn voor de kern en het aantal elektronen in de buitenste elektronenlaag, het aantal valentie -elektronen.
De elektronen van de buitenste laag zijn die die covalente chemische bindingen kunnen vormen, die het vermogen hebben om kationen of anionen te vormen en die welke de oxidatietoestand aan de chemische elementen geven.
Ze zullen ook de atomaire straal bepalen. Naarmate N groter wordt, neemt de atomaire straal toe. Wanneer een atoom een elektron verliest, zal er een samentrekking van de atoomradius zijn vanwege de afname van de negatieve belasting rond de kern.
De elektronen van de buitenste laag worden in aanmerking genomen door de Valencia Link -theorie, theorie van het kristallijne veld en de moleculaire orbitale theorie om de eigenschappen van de moleculen en de hybridisaties van de bindingen te verkrijgen.
Referenties
- AUFBAU Main. Chem hersteld.Librhetxts.borg.
- Bozeman Science. Elektronen configuratie. Hersteld van YouTube.com.
- Elektronenconfiguraties en de eigenschappen van atomen. Hersteld van Oneonta.Edu.

