Dichloormethaanstructuur, eigenschappen, gebruik, toxiciteit
- 4793
- 141
- Pete Heaney V
Hij dichloormethaan, Ook bekend als methyleenchloride, het is een organische verbinding waarvan de chemische formule ch is2Klet2. In het bijzonder is het een alkylhalogenide afgeleid van methaangas. In tegenstelling tot methaan is deze verbinding een kleurloze en polaire vloeistof.
Het werd aanvankelijk in 1839 gesynthetiseerd door de Franse chemicus en natuurkundige Henri Victor Regnault (1810-1878), die hem erin slaagde om hem te isoleren van een mengsel van chloor en chloormethaan blootgesteld aan zonlicht.
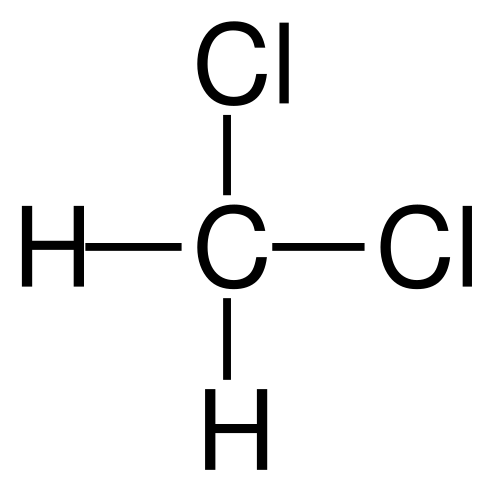 Structurele formule van het dichloormethaan. Bron: Jü [Public Domain]
Structurele formule van het dichloormethaan. Bron: Jü [Public Domain] Het dichloormethaan komt industrieel voor door de behandeling van methaan of chloormethaan met chloorgas bij hoge temperatuur (400-500 ºC). Samen met het dichloormethaan komen ze voor in het chloroform- en koolstoftetrachlorideproces, die worden gescheiden door destillatie.
Het dichloormethaan wordt gebruikt als een oplosmiddel dat het lassen van plastic materialen mogelijk maakt en metalen afbreekt. Het wordt ook gebruikt in koffie en thee -cafaffin.
Het dichloormethaan is een giftige verbinding die kan veroorzaken door inhalatie -irritatie van de neusgaten en keel. Hepatische schade is gemeld bij blootgestelde werknemers aan hoge concentraties van het dichloormethaan. Bovendien is hij mutagene middel, die ervan wordt verdacht carcinogeen te zijn.
[TOC]
Structuur
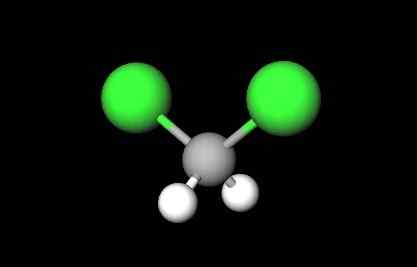
 Moleculaire structuur van het dichloormethaan. Bron: Gabriel Bolívar via Molview.
Moleculaire structuur van het dichloormethaan. Bron: Gabriel Bolívar via Molview. In het eerste beeld werd de structurele formule van de CH getoond2Klet2, waarin hun covalente bindingen C-H en C-Cl opvallen. Omhoog en de structuur ervan weergegeven door een model van bollen en bars. Merk op het eerste gezicht op dat C-H-bindingen (witte bollen) kort zijn, terwijl C-Cl (groene bollen) bindingen lang zijn.
Cho -geometrie2Klet2 Het is tetraëdrisch; maar vervormd vanwege de meest omvangrijke chlooratomen. Eén uiteinde van het tetraëder wordt gedefinieerd door de twee chlooratomen, meer elektronegatief dan waterstof en koolstof. Daarom in het molecuul van CH2Klet2 Er wordt een permanent dipoolmoment vastgesteld (1.6d).
Kan u van dienst zijn: neutralisatiereactieHierdoor kunnen dichloormethaanmoleculen met elkaar communiceren via dipool-dipolo-krachten. Evenzo zijn deze intermoleculaire interacties verantwoordelijk voor deze verbinding om te bestaan als een vloeistof ondanks de lage moleculaire massa; Een vloeistof die echter behoorlijk vluchtig is.
Eigenschappen
Verschijning
Kleurloze vloeistof.
Molaire massa
84.93 g/mol.
Geur
Zoet, vergelijkbaar met chloroform.
Geurdrempel
205 - 307 ppm.
Dikte
1.3266 g/cm3 (20 ºC).
Smeltpunt
- 97,6 ºC.
Kookpunt
39,6 ºC.
Oplosbaarheid in water
25,6 g/l bij 15 ºC en 5,2 g/l A 60 ºC.
Het dichloormethaan is nauwelijks oplosbaar in water. Terwijl beide moleculen, cho2Klet2 en h2Of ze zijn polair, hun interacties zijn mogelijk inefficiënt vanwege afstoting tussen chloor- en zuurstofatomen.
Oplosbaarheid in andere oplosmiddelen
Mengbaar met ethylacetaat, alcohol, hexaan, benzeen, koolstoftetrachloride, Dietylether, chloroform en dimethylformamide.
Octanol/waterpartitiecoëfficiënt
Log p = 1.19.
Dampdruk
57,3 kPa (25 ºC). Deze druk komt overeen met ongeveer 5,66 atm, wat een hoge stoomdruk weerspiegelt.
Stoomdichtheid
2.93 in luchtrelatie genomen als 1.
Brekingsindex (πD)
1.4244 (20 ºC).
Smurrie
0.413 CP (25 ºC).
ontstekingspunt
Het dichloormethaan is niet ontvlambaar, maar wanneer gemengd met de lucht vormt het ontvlambare dampen boven 100 ºC.
Zelf -richtingtemperatuur
556 ºC.
Stabiliteit
Het is stabiel bij omgevingstemperatuur in afwezigheid van vocht, met een relatieve stabiliteit in vergelijking met zijn congeneren: koolstoftetrachloroform en tetrachloride.
Het heeft de neiging om te carbonaliseren bij hoge temperaturen (300-450 ºC), wanneer hun dampen in contact komen met stalen en metalen chloriden.
Ontleding
Het kan worden opgesplitst in contact met hete oppervlakken of een vlam, waardoor giftige en irritante dampen van phosgen en waterstofchloride uitzenden.
Kan u van dienst zijn: differentiaal elektronCorrosie
Het dichloormethaan valt enkele vormen van kunststoffen, rubbers en coatings aan.
Verdampingswarmte
28,82 kJ/mol A 25 ºC.
Oppervlaktespanning
28.20 Dynas/cm bij 25 ºC.
Reactiviteit
Het dichloormethaan reageert sterk met actieve metalen, zoals kalium, natrium en lithium. Reageert met sterke bases, bijvoorbeeld kaliumbouthexide. Het is onverenigbaar met bijtende stoffen, oxidatiemiddelen en chemisch actieve metalen.
Bovendien reageert het met vloeibare zuurstof in natrium- en kaliumlegeringen en stikstoftetroxide. In contact met water kun je wat roestvrij staal, nikkel, koper, evenals ijzer uitvoeren.
Toepassingen
De meeste toepassingen en toepassingen van het dichloormethaan zijn gebaseerd op zijn eigenschappen als oplosmiddel. Vanwege dit kenmerk wordt het dichloormethaan gebruikt in voedsel, transport, productieproductie -industrie, enz.
Voedselverwerking
Het dichloormethaan wordt gebruikt in de cafeïnevrije koffiekranen en theebladeren. Het wordt ook gebruikt voor hop -extractie voor bier, drankjes en andere voedselvlaggen, evenals voor kruidenverwerking.
Farmaceutische industrie
Het dichloormethaan wordt gebruikt voor de bereiding van cefalosporine en ampicilline, naast de productie van antibiotica, steroïden en vitamines.
Fotografie
Het wordt ook gebruikt als een oplosmiddel bij de productie van cellulose -triacetaat (CTA), gebruikt bij het creëren van beveiligingsfilms.
Elektronische industrie
Het is een ideale verbinding voor de productie van gedrukte circuitplaten, met behulp van het aluminiumoppervlak voordat de plaatfotoret wordt toegevoegd.
Verven
Het dichloormethaan is een oplosmiddel dat wordt aangetroffen in vernissen en in verfafscheiders, gebruikt om vernissen of coating van schilderijen van verschillende soorten oppervlakken te elimineren.
Vervoer
Het dient om metalen onderdelen en oppervlakken in spoorwegapparatuur te degraderen, evenals in vliegtuigcomponenten.
Kan u van dienst zijn: gedistilleerd waterAndere gebruiken
Het wordt gebruikt als een spray -drijfgas (aerosolen) en als een expansiemiddel voor polyurethaanschuim. Het wordt ook gebruikt als een vloeistof in sommige soorten kerstverlichting.
Toxiciteit
Acute effecten
Dichloormethaaninademing kan de irritatie van de bovenste luchtwegen, hoest, piepende ademhaling of gebrek aan lucht veroorzaken.
Het kan roodheid van de huid produceren, en als de verbinding er lang op blijft, veroorzaken ze chemische brandwonden. In contact met de ogen produceert het dichloormethaan een ernstige irritatie die zich kan uitstrekken tot een brandwond.
Bovendien fungeert het als een neurotoxine die visuele, auditieve en psychomotorische veranderingen genereert; Maar deze effecten zijn omkeerbaar om het inademen van het dichloormethaan te stoppen.
Chronische effecten
Het dichloormethaan kan het centrale zenuwstelsel beïnvloeden en hoofdpijn, mentale verwarring, misselijkheid, braken en geheugenverlies genereren.
Bij dieren heeft het schadelijke effecten op de lever, nieren, centraal zenuwstelsel en cardiovasculair systeem.
Zodra carcinogenese geen significante toename van het sterfgevallen door kanker heeft gemeld bij werknemers die zijn blootgesteld aan dichloormethaan. Dierstudies hebben echter een toename aangetoond die te wijten is aan dichloormethaan in de incidentie van leverkanker en longen, evenals goedaardige tumoren van de borstklieren.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5ta Editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Nationaal centrum voor biotechnologie -informatie. (2020). Dichloormethaan. PubChem -database., CID = 6344. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2020). Dichloormethaan. Opgehaald uit: in.Wikipedia.borg
- Brumer. (14 juli 2018). Dichloormethaan. Hersteld van: Brumer.com
- MSDS online. (2019). Dichloormethaan (methyleenchloride) gevaren en veiligheidsinformatie. Opgehaald uit: MSDSONLINE.com
- EPA. (2000). Methyleenchloride (dichloormethaan). [PDF]. Hersteld van: EPA.Gov
- « Bepaling van asmethoden en voorbeelden
- Zuid -Korea cultuurtradities, gebruiken, gastronomie, religie »

