Chrome (CR)

- 2979
- 263
- Miss Herman Russel
 Chrome is een zeer reactief metaal. Wikimedia Commons
Chrome is een zeer reactief metaal. Wikimedia Commons Wat is chroom?
Hij chroom (CR) is een chemisch element van groep 6 (VIB) van het periodiek systeem. Jaarlijks worden ton van dit metaal geproduceerd door extractie van chromiet of magnesiummineraal (Fecr2OF4, Mgcr2OF4), die worden verminderd met steenkool om metaal te verkrijgen. Het is erg reactief en alleen in zeer reducerende omstandigheden is het in zijn pure vorm.
Zijn mineralen en oxiden, evenals een klein metaalachtig koperen gedeelte, maken dit element het nummer 22 van de meest voorkomende cortex van de aarde bezetten.
Chroomchemie is zeer divers omdat het links kan vormen met bijna het gehele periodieke tabel. Elk van de verbindingen vertoont kleuren die afhankelijk zijn van het oxidatienummer, evenals de soorten die ermee omgaan.
Vorm ook links naar koolstof, tussenbeide komen in een groot aantal organomethalische verbindingen.
Chrome -kenmerken en eigenschappen
Chroom is een zilvermetaal in zijn pure vorm, met atoomnummer 24 en een molecuulgewicht van ongeveer 52 g/mol (52Cr, zijn meest stabiele isotoop).
Gezien zijn sterke metaalverbindingen, presenteert het fusiepunten (1907 ºC) en koken (2671 ºC) hoog. Ook maakt de kristallijne structuur het een zeer dicht metaal (7.19 g/ml).
Het reageert niet met water om hydroxiden te vormen, maar met zuren. Het oxideert met de zuurstof van de lucht die in het algemeen chroomoxide produceert, wat een veel gebruikt groen pigment is.
Deze oxidelagen creëren wat bekend staat Passivering, Het metaal beschermen tegen daaropvolgende corrosies, omdat zuurstof niet door de metalen sinus kan doordringen.
De elektronische configuratie is [AR] 4S13D5, Met alle ontbrekende elektronen, en daarom vertoont het paramagnetische eigenschappen. Het paren van elektronische spins kan echter optreden als metaal wordt onderworpen aan lage temperaturen, waarbij andere eigenschappen worden verwerven, zoals antiferromagnetisme.
Kan u van dienst zijn: refractaire materialenChemische chroomstructuur
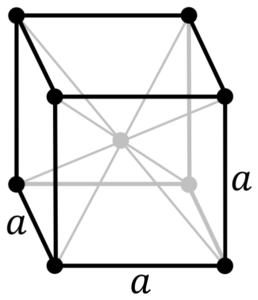 Chrome metaalstructuur. Bron: door originele PNGS door Daniel Mayer, Drbob, Wikimedia Commons
Chrome metaalstructuur. Bron: door originele PNGS door Daniel Mayer, Drbob, Wikimedia Commons Wat is de structuur van chroommetaal? In zijn pure vorm neemt chroom een kubieke kristallijne structuur aan die op het lichaam is gecentreerd (CC of BCC). Dit betekent dat het chroomatoom zich in het midden van een kubus bevindt, waarvan de randen worden bezet door andere chromen (zoals in het superieure beeld).
Deze structuur is verantwoordelijk voor chroom met een hoge smelt- en kookpunten, evenals grote hardheid. Koperatomen overlappen hun S- en D -orbitalen om rijbanden te vormen volgens de bandtheorie.
Beide banden zijn dus vol in tweeën omdat hun elektronische configuratie [AR] 4S is13D5, En als de orbitale S, kunnen twee elektronen en de orbitalen van tien huisvesten. Vervolgens wordt slechts de helft van de banden gevormd door hun overlappingen bezet door elektronen.
Met deze twee perspectieven -de kristallijne structuur en de metalen link -veel van de fysieke eigenschappen van dit metaal kunnen in theorie worden verklaard. Evenmin verklaart niet waarom Chrome verschillende toestanden of oxidatienummers kan hebben.
Hiervoor een diep begrip van de stabiliteit van het atoom met betrekking tot elektronische spins.
Chrome oxidatienummer
Omdat chrome elektronische configuratie [AR] 4S is13D5 Je kunt maximaal een of twee elektronen winnen (CR1- en Cr2-), of verliezen ze om verschillende oxidatienummers te verwerven.
Dus als het chroom een elektron verliest, zou het zijn als [ar] 4s03D5; Als je er drie verliest, [ar] 4s03D3; En als je ze allemaal verliest, [ar], of wat hetzelfde is, zou het isolectronisch zijn voor argon.
Kan u van dienst zijn: kookpunt: concept, berekening en voorbeeldenChroom verliest of verkrijgt geen elektronen door louter opwelling: er moet een soort zijn die ze heeft gedaan of accepteren om van het ene oxidatienummer naar het andere te gaan.
Het chroom heeft de volgende oxidatienummers: -2, -1, 0, +1, +2, +3, +4, +5 en +6. Van hen de +3, Cr3+, Het is de meest stabiele en daarom de overheersende van allemaal; gevolgd door +6, CR6+.
Chrome gebruikt
Als kleurstof of pigment
Het chroom heeft een breed scala aan toepassingen, van kleurstof voor verschillende soorten stoffen, tot de beschermer die de metalen stukken verfraait, in wat bekend staat als chromed, dat kan worden gedaan met puur metaal, of met CR -verbindingen (III) of CR (Vi).
Cromic fluoruro (CRF3), het wordt bijvoorbeeld gebruikt als een kleurstof voor wollen doeken; Cromic sulfaat (Cr2(SW4))3), het is voorbestemd om emaille, keramiek, schilderijen, inkten, vernissen te kleuren, en dient ook voor chromarmetalen; en chroomoxide (Cr2OF3) Zoek ook gebruik waar de aantrekkelijke groene kleur nodig is.
Daarom kan elk chromen mineraal met intense kleuren bestemd zijn om een structuur te verven, maar daarna het feit of deze verbindingen gevaarlijk zijn of niet voor het milieu of voor de gezondheid van individuen.
In feite worden de giftige eigenschappen gebruikt om hout en andere insectenaanvaloppervlakken te behouden.
In verchroomde of metallurgie
Evenzo worden kleine hoeveelheden chroom aan staal toegevoegd om het te versterken in het gezicht van oxidatie en om de helderheid ervan te verbeteren. Dit komt omdat het in staat is om grijze carbiden te vormen (CR3C2) Zeer bestand bij het reageren met de zuurstof van de lucht.
Kan u van dienst zijn: calciumhydroxide (ca (oh) 2): structuur, eigenschappen, verkrijgen, gebruikOmdat chroom kan polijsten tot heldere oppervlakken, presenteren chroom vervolgens zilveren ontwerpen en kleuren als een goedkoper alternatief voor deze doeleinden.
Voedings-
Enig debat als chroom kan worden beschouwd als een essentieel element, dat wil zeggen onmisbaar in het dagelijkse dieet. Het is aanwezig in sommige voedingsmiddelen in zeer kleine concentraties, zoals groene bladeren en tomaten.
Er zijn ook eiwitsupplementen die de insuline -activiteit reguleren en spiergroei bevorderen, zoals het geval is bij chromen polynicotinato.
Waar is het chroom?
Chroom wordt gevonden in een grote verscheidenheid aan mineralen en edelstenen, zoals robijnen en smaragden. Het belangrijkste mineraal waaruit het chroom wordt geëxtraheerd, is het chromiet (MCR2OF4), Waarbij M elk ander metaal kan zijn waarmee chroomoxide is geassocieerd. Deze mijnen zijn er in overvloed in Zuid -Afrika, in India, Turkije, Finland, Brazilië en andere landen.
Elke bron heeft een of meer chromietvarianten. Op deze manier, voor elke M (geloof, Mg, Mn, Zn, enz.) Er ontstaat een ander chromen mineraal.
Om het metaal te extraheren is het noodzakelijk. Dit wordt gedaan met koolstof of aluminium:
Fecr2OF4 + 4c => fe + 2cr + 4co
Evenzo wordt de chromita gevonden (pbcro4)).
Meestal, in een mineraal waar de ionen Cr3+ kan al vervangen3+, Beide met enigszins vergelijkbare ionische radio's, vormt een onzuiverheid die resulteert in een andere natuurlijke bron van dit verbazingwekkende maar schadelijke metaal.
Referenties
- Tenebaum E. Chroom. Genomen van: chemie.Pomona.Edu
- Chemistry Libhethexts. Chemie van chroom. Genomen uit: chem.Librhetxts.borg
- Chroom. Uitgevallen van: chemiexplaed.com

