Zilveren chromaat (Ag2cro4)
- 4296
- 598
- Lonnie Rohan
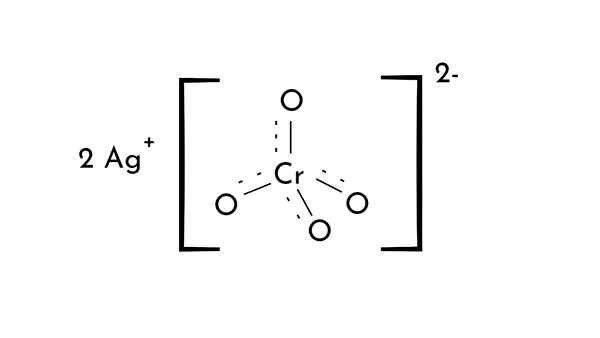
 Chemische structuur van zilverchromaat. Met licentie
Chemische structuur van zilverchromaat. Met licentie Wat is zilveren chromaat?
Hij Zilveren chromaat Het is een chemische verbinding van formule Ag2Cro4. Het is een van de chroomverbindingen in de oxidatietoestand (VI) en er wordt gezegd dat het de voorloper van moderne fotografie is.
Samengestelde voorbereiding is eenvoudig. Het wordt geproduceerd door een uitwisselingsreactie met een oplosbaar zilverzout, zoals die tussen kaliumchromaat en zilvernitraat.
23(aq) + na2Cro4(aq) → Ag2Cro4(s) + 2nano3(aq)
Bijna alle alkalische en nitraatmetaalverbindingen zijn oplosbaar, maar de meeste zilververbindingen zijn onoplosbaar (behalve acetaten, perchloraten, chlorines en nitraten).
Daarom, wanneer oplosbare zouten worden gemengd met zilvernitraat en natriumchromaat, vormen zilverchromaat onoplosbaar en neerslag.
Fysische en chemische eigenschappen van zilverchromaat
Zilverchromaat zijn rode of bruine monokliene kristallen zonder karakteristieke geur of smaak.
De verbinding heeft een molecuulgewicht van 331,73 g/mol en een dichtheid van 5.625 g/ml. Het heeft een punt van 1.550 ° C en is zeer weinig oplosbaar in water en oplosbaar in salpeter- en ammoniakzuur.
Zoals alle chroomverbindingen (VI), is zilverchromaat een sterk oxidatiemiddel. Ze kunnen reageren met reducerende middelen om warmte en producten te genereren die gasvormig kunnen zijn (waardoor de onderdrukken van gesloten containers worden veroorzaakt).
Producten kunnen in staat zijn tot andere reacties, zoals luchtverbranding. De chemische reductie van de materialen in deze groep kan snel of zelfs explosief zijn, maar vereist vaak initiatie.
Reactiviteit en gevaren
Zilverchromaat is een sterk, hygroscopisch oxidatiemiddel (dat vocht van de lucht absorbeert) en is gevoelig voor licht. Explosieve mengsels van anorganische oxiderende middelen met reductiemiddelen blijven vaak gedurende lange periodes ongewijzigd als de initiatie wordt vermeden.
Kan u van dienst zijn: ethyleenoxide: structuur, eigenschappen, risico's en gebruikDergelijke systemen zijn meestal mengsels van vaste stoffen, maar ze kunnen elke combinatie van fysieke toestanden impliceren. Sommige anorganische oxiderende middelen zijn in water oplosbare metalen zouten.
Zoals alle chroomverbindingen (VI), is zilverchromaat carcinogeen voor mensen, naast irritant in het geval van huid- of inname -contact.
Hoewel minder gevaarlijk, moet het worden voorkomen in het geval van huidcontact (corrosief), oogcontact (irritant) en inademing. Langdurige blootstelling kan huidbrandwonden en zweren veroorzaken. Overbrenging van inhalatie kan ademhalingsirritatie veroorzaken.
Als de verbinding in contact komt met de ogen, moeten de contactlenzen worden gecontroleerd en verwijderd, als ze dat hebben gedaan. De ogen met veel koud water moeten onmiddellijk gedurende minstens 15 minuten worden gewassen.
In het geval van huidcontact, het getroffen gebied met veel.
Je moet de huid bedekken die geïrriteerd is met een verzachtend lotion. Was kleding en schoenen voordat je ze weer gebruikt. Als het contact ernstig is, was u met een desinfecterende zeep en bedekt u de huid besmet met een antibacteriële crème.
In geval van inhalatie moet het slachtoffer worden overgebracht naar een nieuwe plaats. Als u niet inademt, wordt kunstmatige ademhaling toegediend. Als ademhaling moeilijk is, zorg dan zuurstof.
Als de verbinding wordt ingenomen, mag braken niet worden geïnduceerd tenzij het medisch personeel dit heeft aangegeven. Draai strakke kleding los, zoals shirthals, riem of stropdas.
In alle gevallen moet medische zorg onmiddellijk worden verkregen.
Kan u van dienst zijn: specifieke defectenSilver Chromate -gebruik
Reagens in de Mohr -methode
Zilverchromaat wordt gebruikt als een reagens om het eindpunt in de mohr van argentometrie aan te geven. De reactiviteit van het chromaat met zilver is minder dan de haluros (chloride en anderen). Dus in een mengsel van beide ionen zal zilverchloride worden gevormd.
Alleen als er geen chloride over is (of een halogeen) zal zilverchromaat (roodbruin) vormen en neerslaan.
Vóór het eindpunt heeft de oplossing een melkachtige citroengeel uiterlijk, vanwege de kleur van het chromaation en het reeds gevormde zilveren chloride -neerslag. Naarmate je het laatste punt nadert, leiden zilvernitraattoevoegingen tot een progressieve afname van rode kleuren.
Wanneer de roodachtige bruine kleur (met grijze vlekken van zilveren chloride erin) blijft het eindpunt van de graad. Dit is voor neutrale pH.
In een zeer zure pH is het zilveren chromaat oplosbaar en neerslachtig in Alcalino La Plata pH neer als hydroxide.
Cellulair verven
De vormingsreactie van zilverchromaat is belangrijk geweest in de neurowetenschappen, omdat deze wordt gebruikt in de Golgi -methode voor het kleuren van neuronen voor microscopie: het zilverchromaat produceerde neerslag in de neuronen en maakt de morfologie ervan zichtbaar.
De methode van Golgi is een zilveren kleurtechniek die wordt gebruikt om nerveus weefsel te visualiseren onder optische en elektronische microscopie. De methode werd ontdekt door Camillo Golgi, een Italiaanse arts en wetenschapper, die de eerste foto publiceerde gemaakt met de techniek in 1873.
Kan u van dienst zijn: ethyletherGolgi's kleuring werd gebruikt door de Spaanse neuroanatomist Santiago Ramón y Cajal (1852-1934) om een reeks nieuwe feiten te ontdekken over de organisatie van het zenuwstelsel, die de geboorte van neuronale doctrine inspireerde.
Bovendien verbeterde Ramón Y Cajal de techniek met behulp van een methode die hij "Double Impregnation" noemde. Ramón y Cajal's kleurtechniek, nog steeds in gebruik, wordt Cajal Mancha genoemd.
Nanodeeltjesstudie
Ag microkristallen zijn gesynthetiseerd2Cro4 met behulp van de coprecipitatiemethode.
Deze microkristallen werden gekenmerkt door XRD (XR) diffractie met Rietveld-analyse, elektronische scanning elektronische microscopie door veldemissie (Fe-SEEM), elektronische transmissiemicroscopie (TEM) met energiedispersiespectroscopie (EDS), micro-micro-raman.
Fe-SEEM-microfoto's onthulden de morfologie en groei van Ag-nanodeeltjes over microcristallen van Ag2Cro4 Tijdens bestraling met elektronenstraal.
Theoretische analyses op basis van het niveau van functionele dichtheidstheorie geven aan dat de opname van elektronen verantwoordelijk is voor structurele modificaties en de vorming van defecten in de clusters [aug6] en [geleden4], het genereren van ideale omstandigheden voor de groei van Ag -nanodeeltjes.
Andere gebruiken
Zilverchromaat wordt gebruikt als ontwikkelingsagent voor fotografie. Het wordt ook gebruikt als katalysator voor aldolvorming van alcohol (zilveren chromaat (VI), s.F.) en als een oxidatiemiddel in verschillende laboratoriumreacties.
Referenties
- Nijlchemicaliën (s.F.)). Zilveren chromaat. Hersteld van nilechemicaliën.com.
- Over organisch. Veiligheidsgegevensblad Zilveren chromaatmateriaal, 99%. Hersteld van T3DB.AC.

