Galvanische corrosiemechanismen, voorbeelden, bescherming

- 1034
- 46
- Glen Armstrong
De Galvanische of elektrochemische corrosie Het is een proces waarbij een metaal of legering meer duizelig wordt afgebroken in vergelijking met zijn conventionele oxidatie. Men kan gezegd dat het een versnelde oxidatie is en zelfs opzettelijk geleid; zoals in batterijen of batterijen.
Dit vindt plaats onder een reeks voorwaarden. Ten eerste moet er een actief metaal zijn, anode genoemd. Ook, en ten tweede, moet er een beetje reactief edelmetaal zijn genaamd Cathode. De derde en vierde omstandigheden zijn de aanwezigheid van een medium waar elektronen worden verspreid, zoals water en ionische of elektrolytensoorten.
 Geoxideerde ijzeren kroon. Bron: Pixnio.
Geoxideerde ijzeren kroon. Bron: Pixnio. Galvanische corrosie is waarneembaar, vooral in mariene omgevingen of aan de oevers van de stranden. Luchtstromen heffen waterdampmassa's op, die op zijn beurt sommige ionen slepen; De laatste houdt zich aan een dunne laag water of druppels die op het metaaloppervlak rusten.
Deze omstandigheden van vochtigheid en zoutgehalte geven de voorkeur aan metaalcorrosie. Dat wil zeggen, een ijzeren kroon zoals die in het superieure beeld zal sneller oxideren als deze wordt blootgesteld aan de nabijgelegen zee.
Het gemak dat een metaal zal moeten oxideren in vergelijking met een ander, kan kwantitatief worden gemeten door zijn reductiepotentialen; In de chemieboeken zijn er in overvloedige tafels met deze mogelijkheden en. Hoe negatiever, hoe groter uw neiging om te oxideren.
Ook als dit metaal in aanwezigheid van een ander is met een zeer positief reductiepotentieel, dus met een grote AE, zal de oxidatie van het reactieve metaal agressiever zijn. Andere factoren, zoals pH, ionische kracht, vochtigheid, de aanwezigheid van zuurstof en de relatie tussen de gebieden van het metaal dat wordt geoxideerd en die gereduceerd, zijn ook belangrijk.
[TOC]
Mechanismen
Concepten en reacties
Voordat u de mechanismen achter Galvanic Corrosion aanpakt, moeten bepaalde concepten worden verduidelijkt.
In een reactierédox verliest een soort elektronen (geoxideerd) terwijl een andere hen wint (het is verminderd). De elektrode waarop oxidatie gebeurt, wordt anode genoemd; En waarop de reductie plaatsvindt, wordt de kathode (in het Engels de nemonische regel meestal gebruikt Rode kat onthouden).
Dus voor een elektrode (één stuk, schroef, etc.) van een metaal m, als dit wordt geoxideerd, wordt gezegd dat het de anode is:
M => MN+ + NE-
Het aantal vrijgegeven elektronen zal gelijk zijn aan de grootte van de positieve hoeveelheid kation mN+ resulterend.
Vervolgens ontvangt een andere elektrode of metaal (beide metalen moeten op een of andere manier in contact staan), de vrijgegeven elektronen; Maar dit lijdt geen chemische reactie als ze elektronen krijgen, omdat het ze alleen zou uitvoeren (elektrische stroom).
Daarom moet er een andere soort in oplossing zijn die deze elektronen formeel kunnen accepteren; Als eenvoudig om metaalionen te verminderen, bijvoorbeeld:
Kan u van dienst zijn: inhomogeen systeemRN+ + NE- => R
Dat wil zeggen, een laag metaal r zou zich vormen en de elektrode zou zwaarder worden; Terwijl de metalen M massa zou verliezen omdat hun atomen oplossen.
Depolarisatoren
En als er geen metalen kationen waren die voldoende konden worden verminderd? In dat geval zullen andere soorten die in het midden aanwezig zijn, elektronen nemen: depolariizadores. Deze zijn nauw verwant aan pH: O2, H+, Oh- en h2OF.
Zuurstof en water krijgen elektronen in een reactie die wordt uitgedrukt door de volgende chemische vergelijking:
OF2 + 2h2O + 4e- => 4oH-
Terwijl iones h+ Ze transformeren in h2:
2h+ + 2e- => H2
Dat wil zeggen oh soort- en h2 Het zijn veel voorkomende producten van galvanische of elektrochemische corrosies.
Zelfs als metaal R niet deelneemt aan enige reactie, is het feit dat het nobeler is dat M de oxidatie ervan bevordert; En bijgevolg zal er een grotere productie van OH -ionen zijn- o Waterstofgas. Omdat het tenslotte het verschil is tussen reductiepotentialen, ΔE, een van de belangrijkste motoren van deze processen.
IJzercorrosie
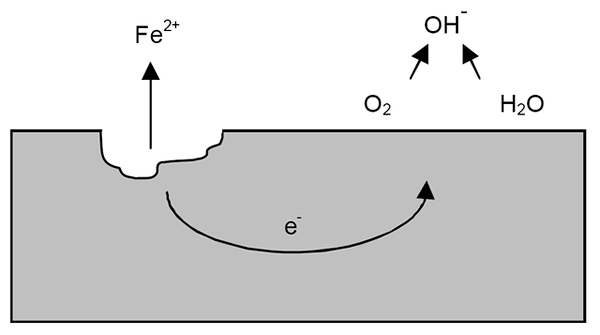 Corrosiemechanisme voor ijzer. Bron: Wikipedia.
Corrosiemechanisme voor ijzer. Bron: Wikipedia. Na de vorige verduidelijkingen kan het voorbeeld van ijzercorrosie (superieure afbeelding) worden aangepakt. Stel dat er een dunne laag water is waarin zuurstof oplost. Zonder de aanwezigheid van andere metalen zullen het de depolarizadores zijn die de reactierichtlijnen zullen markeren.
Zo zal ijzer sommige atomen op het oppervlak verliezen om in water op te lossen als geloofskationen2+:
Fe => geloof2+ + 2e-
De twee elektronen zullen het ijzeren stuk reizen als een goede elektriciteitsgeleider. Zodat het bekend is waar oxidatie of anodische site begon; Maar niet waar de reductie of locatie van de kathodische site zal doorgaan. De kathodische site kan overal zijn; En hoe hoger het mogelijke gebied, erger zal de corrosie van het metaal zijn.
Stel dat elektronen een punt bereiken zoals weergegeven in de bovenste afbeelding. Daar lijden zowel zuurstof als water aan de reeds beschreven reactie, waardoor OH wordt vrijgegeven-. Deze anionen oh- Ze kunnen reageren met geloof2+ Om geloof te vormen (oh)2, die neerslaat en latere oxidaties lijdt die het uiteindelijk omzetten in roest.
Ondertussen barst de anodische site steeds meer.
Voorbeelden
In het dagelijks leven zijn de voorbeelden van galvanische corrosies talrijk. We hoeven niet te verwijzen naar de ijzeren kroon: elk artefact gemaakt van metalen kan hetzelfde proces ondergaan in aanwezigheid van natte en zoutoplossing omgevingen.
Kan u van dienst zijn: fosfaatgroepNaast het strand kan de winter ook bijdragen aan de ideale omstandigheden voor corrosie; Wanneer u bijvoorbeeld zouten naar de weg sneeuw gooit om te voorkomen dat auto's schaatsen.
Vanuit fysiek oogpunt kan het in de gelaste vakbonden van twee metalen vocht vasthouden, actieve corrosiesites zijn. Dit komt omdat beide metalen zich gedragen als twee elektroden, en de meest reactieve zal hun elektronen verliezen.
Als oh ionenproductie- Het is aanzienlijk, u kunt zelfs de verf van de auto of het artefact in kwestie uitvoeren.
Anodische indices
Men kan hun eigen voorbeelden van galvanische corrosies bouwen met behulp van de reductiepotentiaaltabellen. De anodische indextabel (op zichzelf vereenvoudigd) zal echter worden gekozen om dit punt te illustreren.
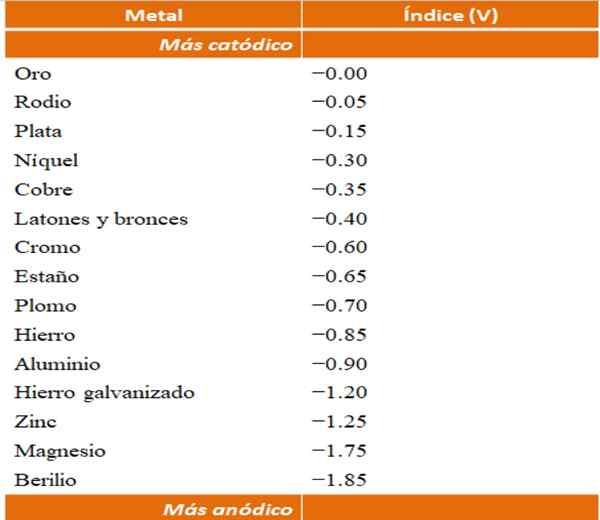 Anodische indices voor verschillende metalen of legeringen. Bron: Wikipedia.
Anodische indices voor verschillende metalen of legeringen. Bron: Wikipedia. Stel bijvoorbeeld dat we een elektrochemische cel willen bouwen. De metalen die het bovenste deel van de tabel Anodische indices zijn, zijn meer kathode; dat wil zeggen, ze worden gemakkelijk verminderd en het zal daarom moeilijk zijn om ze in oplossing te hebben. Terwijl metalen die onderaan staan, meer anodisch zijn of reagentia, en gemakkelijk loopt.
Als we voor goud en beryllium kiezen, kunnen beide metalen niet lang samen zijn, omdat Beryllium met extreme snelle zou oxideren.
En als we daarentegen een Ag Ion -oplossing hebben+ En we dompelen een aluminium balk in, deze zal op hetzelfde moment oplossen dat metalen zilverdeeltjes neerslaat. Als deze balk verbinding maakt met een grafiet -elektrode, zouden elektronen er naartoe reizen om zilver als een zilveren film elektrochemisch te deponeren.
En als in plaats van de aluminiumbalk uit koper is, zou de oplossing blauwachtig worden door de aanwezigheid van de ionen cu2+ in water.
Bescherming tegen elektrochemische corrosie
Offers opoffering
Stel dat het bedoeld is om een corrosielam te beschermen in aanwezigheid van andere metalen. De eenvoudigste optie zou zijn om magnesium toe te voegen, dat het zink zou bedekken, zodat, eenmaal geoxideerd, de elektronen die uit magnesium worden vrijgegeven, de Zn -kationen verminderen2+ rug.
De film van MGO over zink zou echter eerder in plaats van later kraken, waardoor de huidige locatie met een hoge dichtheid wordt geboden; dat wil zeggen, zinkcorrosie zou op die punten scherp versnellen.
Deze beschermingstechniek tegen elektrochemische corrosie staat bekend als het gebruik van opofferingsbekleding. De bekendste is zink, gebruikt in de beroemde techniek genaamd Galvanisatie. In hen is metaal M bedekt, vooral ijzer, zink (geloof/Zn).
Kan u van dienst zijn: fenolftaleïne (C20H14O4)Nogmaals, zink oxideert en zijn oxide dient om ijzer te bedekken en elektronen over te dragen die het geloof verminderen2+ dat kan worden gevormd.
Nobele coatings
Stel nogmaals dat u hetzelfde zinkblad wilt beschermen, maar nu zal chroom worden gebruikt in plaats van magnesium. Chroom is nobeler (meer kathodisch, zie de tabel van anodische indices) dan zink, en daarom werkt het als een nobele coating.
Het probleem van dit type coating is dat zodra het barst, het de oxidatie van het hieronder zal bevorderen en verder versnellen; In dit geval is zink nog meer gecorrodeerd dan bedekt zijn met magnesium.
En ten slotte zijn er andere coatings die bestaan uit schilderijen, kunststoffen, antioxidanten, vetten, harsen, enz.
Kinderen experiment
IJzeren plaat in koperen zouten
Een eenvoudig experiment kan worden bedacht door dezelfde tabel met anodische indices. Een redelijke hoeveelheid (minder dan 10 gram) CUSO oplossen4· 5h2Of in water wordt een kind gevraagd zich onder te dompelen op een gepolijste ijzeren plaat. Er wordt een foto gemaakt en het proces mag zich een paar weken ontwikkelen.
De oplossing is in eerste instantie blauwachtig, maar het begint de kleur te verliezen terwijl de ijzeren plaat een koperachtige kleur krijgt. Dit komt omdat koper nobel is dan ijzer, en daarom zijn kationen cu2+ Ze zullen worden gereduceerd tot metallic koper van de ionen die zijn toegewezen door de oxidatie van ijzer:
Fe => geloof2+ + 2e-
Cu2+ + 2e- => Cu
Zilveroxide -reiniging
Zilveren objecten zijn in de loop van de tijd zwart, vooral als ze contact hebben met een bron van zwavelverbindingen. Het oxide kan worden verwijderd als het object wordt ondergedompeld in een waterkub met natriumbicarbonaat en aluminiumfolie. Bicarbonaat biedt elektrolyten die het transport van elektronen tussen het object en aluminium vergemakkelijken.
Als gevolg hiervan kan het kind waarderen dat het object zijn zwarte vlekken verliest en zal schijnen met zijn karakteristieke zilveren kleur; Terwijl de aluminiumfolie loopt totdat ze verdwijnen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2019). Galvanische corrosie. Opgehaald uit: in.Wikipedia.borg
- Stephen lager. (16 juni 2019). Electochemische corrosie. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- De open universiteit. (2018). 2.4 Corrosieproces: Galvanische corrosie. Hersteld van: open.Edu
- Klant Technical Service Brush Wellman Inc. (S.F.)). Een gids voor galvanische corrosie. Borstel Wellman Engineered Materials.
- Giorgio carboni. (1998). Experimenten in electochemie. Opgehaald uit: Fensci.com
- « Sophist relativisme oorsprong, kenmerken, voorbeelden
- Cyclische koolwaterstoffenstructuur, eigenschappen, voorbeelden »

