Snelheid constant

- 4280
- 785
- Alton D'Amore
Wat is de snelheidsconstante?
De Snelheid constant Het is een constante van evenredigheid van de snelheidswet van chemische kinetiek, die een relatie tot stand brengt tussen de molaire concentratie van de reagentia en de snelheid van de reactie.
Naarmate de reagentia worden verbruikt, nemen de reactiesnelheden ook af, ook afnemen. Dat is de reden waarom in de berekeningen van de snelheidsconstante, weergegeven door het 'K' -symbool, de beginsnelheden in aanmerking worden genomen, om een vergelijkingspunt te hebben tussen verschillende experimenten.

De chemische kinetiek geeft aan dat deze constante afhankelijk is van de reactieorders van de reagentia, waarvan de concentraties de snelheid van de reactie zullen veranderen. Aan de andere kant hangt K volgens de Arrhenius -vergelijking ook af van de temperatuur- en activeringsenergie voor de reactie.
Daarom wordt gezegd dat de snelheidsconstante geen echte constante is, omdat deze varieert met de temperatuur en ook met de aanwezigheid van katalysatoren die de activeringsenergie wijzigen. Daarom zijn er niet veel tabellen waar ze komen voor specifieke reacties (en voorwaarden).
Bijvoorbeeld, voor een reactie waarbij A en B reageren, elk met een volgorde van reactie van 1, de constante gerapporteerde K tot 25 ° C, en met de toevoeging van een bepaalde hoeveelheid katalysator zal het niet hetzelfde zijn als de reactie wordt gemaakt tot een temperatuur van 26 of 27 ºC. De minste variatie heeft invloed op de waarde van K, die alleen constant is tijdens de voorwaarden die zijn vastgesteld voor experimenten.
Hoe de snelheidsconstante te berekenen?
Experimenteren
De bepaling van de waarde van de snelheidsconstante van een reactie wordt experimenteel gemaakt. Als u bijvoorbeeld de waarde van de snelheidsconstante wilt bepalen voor een reactie van de vorm:
A +B → C
Voor de oprichting van de waarde van K kunnen drie reacties worden gemaakt, met de volgende verschillen: in reactie 2 is de initiële concentratie van reagens A constant, [A], maar wordt bijvoorbeeld verdubbeld, bijvoorbeeld de concentratie van reagens B, [ B].
Ondertussen wordt in reactie 3 [a] verdubbeld in vergelijking met reactie 1, waardoor constant blijft [b].
Er zal dus een tabel met concentraties worden gebouwd die zal dienen om de initiële snelheden tussen verschillende experimenten te vergelijken. Dit met het doel om de reactiebevelen te bepalen, en opeenvolgend om de snelheidsconstante te berekenen.
Kan u van dienst zijn: aluminiumhydroxide: structuur, eigenschappen, gebruik, risico'sReactieorders
Eerste berekening
Voor de vorige reactie wordt de snelheid tot uitdrukking gebracht door de vergelijking:
Reactiesnelheid = k · [a]X· [B]En
Waar 'x' e 'en' overeenkomen met de reactieorders voor reagentia A en B, respectievelijk.
Om de waarden van de reactieorders te bepalen, moet een vergelijking tussen reactie 2 en 1, evenals tussen reactie 3 en 1 worden gemaakt.
Bij het vergelijken van reactie 1 met de 2 kan bijvoorbeeld worden waargenomen dat er door het dupliceren van [b] een duplicatie van de reactiesnelheid is.
Dan: het aandeel van [b] tussen reacties 2 en 1 is 2, evenals de verhouding tussen de snelheden van de reacties. Vervolgens kan de ordewaarde van de reactie worden verkregen met betrekking tot B (exponent en), via de volgende benadering:
 Berekening van de volgorde van reactie 'en'. Bron: Gabriel Bolívar.
Berekening van de volgorde van reactie 'en'. Bron: Gabriel Bolívar. De snelheid van het experiment 2 is twee keer sneller dan de snelheid van het experiment 1. Dus het verdelen van de twee hierboven zullen we hebben:
2 = 2En
Daarom, 'en' Vale 1, kunnen concluderen dat de volgorde van de reactie met betrekking tot reagens B van de eerste orde is.
Tweede berekening
Op dezelfde manier gaan we verder met de reagens A voor de berekening van 'x':
 Berekening van de volgorde van reactie 'x'. Bron: Gabriel Bolívar.
Berekening van de volgorde van reactie 'x'. Bron: Gabriel Bolívar. De snelheid van het experiment of reactie 3 is vier keer hoger dan het experiment of reactie 1. Daarom:
4 = 2X
OF
22 = 2X
En de waarde van x is 2, dus de reactie is de tweede orde in relatie tot het reagens.
Eindopruiming
Vervolgens kan de waarde van de snelheidsconstante op basis van een van de reacties worden vastgesteld:
Reactiesnelheid = k · [a]2· [B]
Genoeg om experimentele waarden te introduceren en kwijt te zijn:
K = reactiesnelheid / ([A]2· [B])
Voorbeelden
De volgende voorbeelden dienen als een inleiding voordat de oefeningen uit de volgende sectie zijn opgelost.
voorbeeld 1
In een chemische reactie:
A) Als de initiële concentratie van een reagens de snelheid van de reactie wordt verdubbeld: wat is de volgorde van de reactie ten opzichte van dit reagens?
b) Als de toename van de reagensconcentratie een toename van snelheid in een factor 8 veroorzaakt, wat zou dan de volgorde van reactie zijn dan?
c) Als de concentratie van het reagens een verandering ervaart en de snelheid hetzelfde blijft: wat is de volgorde van de reactie ten opzichte van het reagens?
Het kan u van dienst zijn: cycopropaan (C3H6)In a) is het aandeel van reactiesnelheden hetzelfde en is het aandeel reagensconcentraties gelijk aan 2X,
2 = 2X
Daarom is x = 1 en de volgorde van de reactie ten opzichte van het reagens 1.
In b) Het aandeel van de reactiesnelheid is hetzelfde 8 (23) en het aandeel van reagensconcentraties is gelijk aan 2X,
23 = 2X
Daarom is x = 3 en de volgorde van de reactie ten opzichte van het reagens 3-
Terwijl in c) de snelheid van de reactie onafhankelijk is van de concentratie van het reagens, dus de volgorde van de reactie ten opzichte van het reagens is nul.
Voorbeeld 2
De reactie:
2 Nee2 + OF2 → 2 Nee2
Het heeft de uitdrukking van de volgende snelheidswet:
Reactiesnelheid = k · [nee2]2·OF2.
Wat is de wereldwijde volgorde van de reactie? Welke eenheden zouden k hebben?
De volgorde van de reactie met betrekking tot of2 Het is 1, en de volgorde van de reactie met betrekking tot niet2 Het is 2, dus de globale volgorde van de reactie is de som van deze waarden, dat wil zeggen 2 + 1 = 3.
De snelheid van de reactie heeft m/s -eenheden en de concentraties van de reagentia worden uitgedrukt in m. Een analyse maken van de eenheden die we zullen hebben:
k = reactiesnelheid / ([nee2]2·[OF2]
= (M / s) / (m3))
= S-1M-2
Opgeloste oefeningen
Oefening 1
De gegevens van de volgende reactie werden verkregen bij 25 ° C:
A +2 B → C +2 D
Wat is de uitdrukking van de snelheidswet van deze reactie? Wat is de waarde van uw snelheidsconstante?
Berekeningen van reactieorders
Experimentele gegevens zijn:
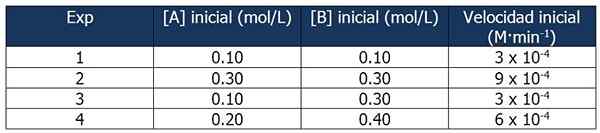 Cineic -gegevens van oefening 1. Bron: Gabriel Bolívar.
Cineic -gegevens van oefening 1. Bron: Gabriel Bolívar. Met de vergelijking van experimenten 1 en 3 kunt u de volgende conclusies trekken:
Verhouding tussen de snelheden van reacties 3 en 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Maar het aandeel tussen B -concentraties is:
(0.3 mol / l) / (0.1 mol/l) = 3
De snelheid van de reactie is onafhankelijk van de concentratie van B, omdat de toename ervan niet beïnvloedt. Daarom is de volgorde van de reactie met betrekking tot reagens B nul.
Aan de andere kant staat de vergelijking van reacties 4 en 1 de volgende conclusies toe:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Ondertussen is de verhouding tussen [A] van reacties 4 en 1 gelijk aan:
Kan u van dienst zijn: 5 kenmerken van homogene mengsels(0.20 mol / l) / (0.10 mol/l) = 2X
Dan zal de relatie tussen de verhoudingen zijn:
2 = 2X
x = 1
Daarom is de uitdrukking van de snelheidswet:
Reactiesnelheid = k · [a]
B wordt niet opgenomen omdat de volgorde van de reactie nul is.
Berekening van K
We kunnen de snelheidsconstante berekenen uit een van de kinetische gegevens. Laten we experiment 1 gebruiken:
K = reactiesnelheid / [A]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 of 0.003 min-1
Oefening 2
De reactiesnelheidsgegevens werden bij een bepaalde temperatuur verkregen.
2 clo2 (AC) +2 OH- (AC) → Clo3- (AC) +clo2 (AC) +H2Of (l)
Berekeningen van reactieorders
Experimentele gegevens zijn:
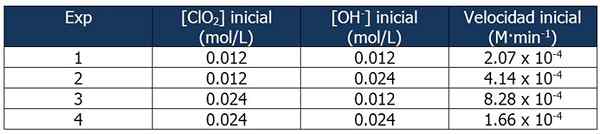 Cineic -gegevens over oefening 2. Bron: Gabriel Bolívar.
Cineic -gegevens over oefening 2. Bron: Gabriel Bolívar. De verhouding tussen de snelheden van reactie 2 en reactie 1 is:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
En het aandeel OH -concentraties- Tussen reacties 2 en 1 is gelijk aan:
(0,024 mol/l)/(0,012 mol/l) = 2X
De exponent 'x' vertegenwoordigt de volgorde van de reactie ten opzichte van het OH -reagens-. De relatie tussen berekende verhoudingen kan als volgt worden weergegeven:
2 = 2X
x = 1
Daarom is de volgorde van de reactie ten opzichte van het OH -reagens- is gelijk aan 1.
In reactie 3 wordt de concentratie van Clo verdubbeld2 van reactie 1, terwijl de concentratie van OH- Blijft constant.
Verhouding tussen de snelheden van reacties 3 en 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22))
En het aandeel van [clo2] tussen reacties 3 en 1 is gelijk aan:
(0,024 mol/l)/(0,012 mol/l) = 2En
De exponent 'en' vertegenwoordigt de volgorde van de reactie met betrekking tot het CLO -reagens2.
De verhoudingen vergelijken:
22 = 2En
4 = 2En
y = 2
Daarom is de reactie tweede ten opzichte van het CLO -reagens2.
De uitdrukking van de snelheidswet zal dan zijn:
Reactiesnelheid = k · [clo2]2· [Oh-]
Berekening van K
Nogmaals, we kunnen k uit de vorige uitdrukking berekenen met behulp van een van de kinetische gegevens voor de experimenten. We zullen experiment 3 gebruiken:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Reactiesnelheid constant. Opgehaald uit: in.Wikipedia.borg
- Chemie Texas A&M University. (S.F.)). Kinetiek: Sample Rate -berekeningen. Hersteld van: chem.tamu.Edu
- Keith J. Laidler. (2020). Reactiesnelheid. Britannica Encyclopaedia. Hersteld van: Britannica.com
- Helmestine, Anne Marie, pH.D. (25 augustus 2020). Wat is de snelheidsconstante in de chemie? Hersteld van: Thoughtco.com
- Clark Jim. (2013). Rate constanten en de Arrhenius -vergelijking. Hersteld van: chemguide.co.Uk

