Quaternaire verbindingen Kenmerken, training, voorbeelden
- 4387
- 316
- Dr. Rickey Hudson
De Quaternaire verbindingen Het zijn allemaal diegenen die vier verschillende atomen of ionen hebben. Daarom kunnen ze moleculaire of ionische soorten zijn. De diversiteit bestaat uit zowel biologische als anorganische chemie, een zeer omvangrijke groep; Hoewel misschien niet zozeer in vergelijking met binaire of ternaire verbindingen.
De reden dat uw nummer kleiner is, is omdat de vier atomen of ionen moeten worden gehouden door hun chemische affiniteiten. Niet alle elementen zijn compatibel met elkaar, en zelfs minder wanneer beschouwd als een kwartet; Plots zijn een paar van hen meer gerelateerd aan elkaar dan met het andere paar.
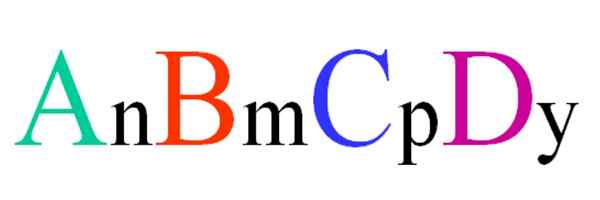 Algemene en willekeurige formule voor een quaternaire verbinding. Bron: Gabriel Bolívar.
Algemene en willekeurige formule voor een quaternaire verbinding. Bron: Gabriel Bolívar. Overweeg een quaternaire verbinding van ABCD willekeurige formule. De subscripts n, m, p e y, zijn de stoichiometrische coëfficiënten, die op hun beurt aangeven welk deel van elk atoom er is in relatie tot de anderen.
Dus formule aNBMCPDEn Het zal geldig zijn als het voldoet aan elektroneutraliteit. Bovendien zal een dergelijke verbinding mogelijk zijn als hun vier atomen dicht genoeg bij elkaar zijn. Men zal zien dat deze formule niet van toepassing is op veel verbindingen, maar vooral voor legeringen of mineralen.
[TOC]
Kenmerken van quaternaire verbindingen
Chemicaliën
Een quaternaire verbinding kan ionisch of covalent zijn en de verwachte kenmerken voor zijn aard vertonen. ABCD ionische verbindingen zullen naar verwachting oplosbaar zijn in water, alcoholen of in andere polaire oplosmiddelen; Ze moeten hoge kook- en fusiepunten hebben en goede elektriciteitsdrivers zijn als ze fuseren.
Wat betreft ABCD -covalente verbindingen bestaan de meeste uit stikstof, geoxygeneerde of gehalogeneerde organische verbindingen; dat wil zeggen, zijn formule zou C wordenNHMOFPNEn of cNHMOFPXEn, X is een halogeenatoom. Van deze moleculen zou het logisch zijn om te denken dat ze polair waren, gezien de hoge elektronegativiteiten van O, N en X.
Kan u van dienst zijn: natriumchloride (NaCl)Een puur covalente ABCD-verbinding kan veel linkmogelijkheden hebben: A-B, B-C, D-A, enz., Afhankelijk van de affiniteiten en elektronische mogelijkheden van atomen. Terwijl in een puur ionische ABCD -verbinding, zijn de interacties elektrostatisch: a+B-C+D-, Bijvoorbeeld.
In het geval van een legering, beschouwd als meer een solide mengsel dan een samenstelling, bestaat ABCD uit neutrale atomen in basale toestanden (in theorie).
Van de rest kan een ABCD -verbinding neutraal, zuur of basic zijn, afhankelijk van de identiteit van zijn atomen.
Fysiek
Fysiek gezien is het waarschijnlijk dat ABCD geen gas wordt, omdat vier verschillende atomen altijd een grotere moleculaire massa of formulering omvatten. Als het geen vloeistof is met een hoog kookpunt, wordt verwacht dat het een vaste stof is, waarvan de ontleding veel producten moet genereren.
Nogmaals, zijn kleuren, geur, textuur, kristallen, enz., Ze zullen onderworpen zijn aan hoe ze naast A, B, C en D bestaan in de verbinding en zullen afhangen van hun synergie en structuren.
Nomenclatuur
Tot nu toe is de kwestie van quaternaire verbindingen op een wereldwijde en onnauwkeurige manier aangepakt. De organische chemie opzij laten (Amidas, Benchilo -chloriden, quaternaire ammoniumzouten, enz.), In anorganische chemie zijn er goed gedefinieerde voorbeelden die zure en basisoxisalen worden genoemd.
Zure oxisals
Zure oxisalen zijn die afkomstig van de gedeeltelijke neutralisatie van een polyprotische oxoacid. Aldus worden een of meer van zijn hydrogenen vervangen door metaalkationen, en hoe minder overblijfsel waterstof bezit, hoe minder zuur het zal zijn.
Bijvoorbeeld fosforzuur, h3Po4, Maximaal twee zure zouten kunnen worden verkregen van bijvoorbeeld natrium. Dit zijn: nee2Po4 (NA+ vervangt een waterstofequivalent aan h+) en NA2HPO4.
Kan u van dienst zijn: selenium: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikVolgens de traditionele nomenclatuur worden deze zouten genoemd, evenals de oxisalen (volledig onbeschermd), maar voorafgaand aan het woord 'zuur' aan de naam van het metaal. Dus de nah2Po4 Het zou natriumdeasfosfaat zijn, en de NA2HPO4 Natriumzuurfosfaat (omdat het een H heeft.
Aan de andere kant geeft de voorraadnomenclatuur de voorkeur aan het woord 'waterstof' dat 'zuur'. De nah2Po4 Het zou zijn om natriumdihydrogen te zijn, en de NA2HPO4 Waterstof natriumfosfaat. Merk op dat deze zouten vier atomen hebben: Na, H, P en O.
Basic oxisals
Basic oxisals zijn die die anion bevatten OH in hun samenstelling-. Overweeg bijvoorbeeld Salt Cano3Oh (CA2+ NEE3- Oh-)). Om het te noemen, zou het voldoende zijn om het woord 'basis' te geven aan de naam van het metaal. Zijn naam zou dus zijn: basiscalciumnitraat. En hoe zit het met Cuio3Oh? Zijn naam zou zijn: Cupric Basic Yodato (Cu2+ Io3- Oh-)).
Volgens de voorraadnomenclatuur wordt het woord 'basis' vervangen door hydroxide, gevolgd door het gebruik van een script vóór de naam van de oxoanion.
Het herhalen van de vorige voorbeelden die hun namen voor elk zijn: calciumhydroxide-nitraat en koperhydroxide-enodate (ii); Herinnerend dat de metalen Valencia tussen haakjes en met Romeinse nummers moet worden aangegeven.
Dubbele zouten
In dubbele zouten zijn er twee verschillende kationen die interactie hebben met hetzelfde type anion. Stel het dubbele zout: Cu3Geloof (po4))3 (Cu2+ Vertrouwen3+ Po43-)). Het is een ijzer- en koperen fosfaat, maar de meest geschikte naam om hiernaar te verwijzen is: drievoudig koper (II) en ijzer (III) fosfaat.
Gehydrateerde zouten
Dit zijn hydraten, en het enige verschil is dat aan het einde van hun namen het aantal waterformuleert is gespecificeerd. Bijvoorbeeld de MNCL2 Het is mangaanchloride (ii).
Kan u van dienst zijn: benzoine: structuur, eigenschappen, gebruik en risico'sZijn hydraat, mncl2· 4h2O Het wordt mangaanchloride (ii) tetrahydraat genoemd. Merk op dat er vier verschillende atomen zijn: MN, CL, H en O.
Een beroemd dubbel en gehydrateerd zout is Mohr's, Faith (NH4))2(SW4))2· 6h2OF. Zijn naam is: dubbel ijzersulfaat (ii) en hexahydraat ammonium.
Opleiding
Nogmaals, gericht op anorganische quaternaire verbindingen, hebben we meestal een product van gedeeltelijke neutralisaties. Als deze optreden in aanwezigheid van verschillende metaaloxiden, zijn dubbele zouten waarschijnlijk; En als het medium erg basic is, zullen de basisoxisalen neerslaan.
En als daarentegen watermoleculen aan de andere kant affiniteit hebben voor metaal, zullen ze direct coördineren met of met de omliggende ionen, waardoor de hydraten worden gevormd.
Aan de zijkant van de legeringen moeten vier verschillende metalen of metalloïden worden gelast voor de productie van condensatoren, halfgeleiders of transistoren.
Voorbeelden
Ten slotte wordt hieronder een lijst met verschillende voorbeelden van quaternaire verbindingen weergegeven. De lezer kan het gebruiken om zijn kennis van de nomenclatuur te testen:
- PBCO3(OH)2
- Cr (HSO4))3
- Nahco3
- ZnioH
- Cu2(OH)2SW3
- Li2Kaso4
- Cuso4· 5h2OF
- Agau (dus4))2
- Geval4· 2H2OF
- Fecl3· 6h2OF
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Anorganische nomenclatuur en formulering. [PDF]. Opgehaald uit: bronnen.onderwijs.is
- Erika thalîa goed. (2019). Dubbele zouten. Academie. Hersteld van: Academie.Edu
- Wikipedia. (2019). Quaternair ammoniumkation. Opgehaald uit: in.Wikipedia.borg

