Kenmerken, training, voorbeelden
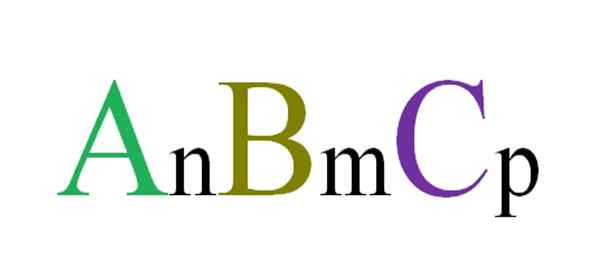
- 2571
- 189
- Aaron Okuneva
De Ternaire verbindingen Het zijn allemaal die bestaan uit drie verschillende atomen of ionen. Ze kunnen zeer divers zijn, van zure of basisstoffen, tot metaallegeringen, mineralen of moderne materialen. De drie atomen kunnen tot dezelfde groep van het periodiek systeem behoren of doorgaan met willekeurige locaties.
Voor de ternaire verbinding moet er echter een chemische affiniteit zijn tussen zijn atomen. Niet iedereen zijn compatibel met elkaar, en daarom kunt u niet gewoon willekeurig kiezen welke drie de verbinding of mengsel zullen integreren en definiëren (uitgaande van het gebrek aan covalente bindingen).
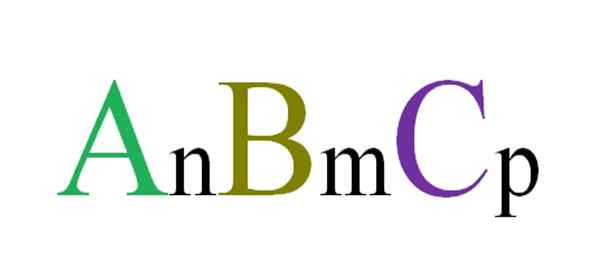 Algemene en willekeurige formule voor ternaire verbindingen. Bron: Gabriel Bolívar.
Algemene en willekeurige formule voor ternaire verbindingen. Bron: Gabriel Bolívar. Er worden bijvoorbeeld willekeurig drie letters gekozen die een ABC ternaire verbinding zullen regelen (superieure afbeelding). Subscripts N, M en P geven stoichiometrische relaties aan tussen atomen of ionen A, B en C. Het variëren van de waarden van dergelijke subscripten, en de identiteiten van de letters, eindeloze ternaire verbindingen worden verkregen.
Formule ANBMCP Het zal alleen geldig zijn als het voldoet aan elektroneutraliteit; dat wil zeggen, de som van uw kosten moet gelijk zijn aan nul. Met dit in gedachten zijn er fysieke (en chemische) beperkingen die leiden tot de vraag of de vorming van genoemde ternaire verbinding mogelijk is.
[TOC]
Kenmerken van ternaire verbindingen
De kenmerken ervan zijn niet algemeen, maar variëren afhankelijk van de chemische aard ervan. Oxoacides en bases zijn bijvoorbeeld ternaire verbindingen, en elk van hen deelt of niet een reeks representatieve kenmerken.
Nu, vóór een hypothetische verbinding ABC, kan dit ionisch zijn, als de verschillen in elektronegativiteit tussen A, B en C niet groot zijn; of covalent, met links A-B-C. De laatste worden gegeven in oneindige voorbeelden binnen organische chemie, zoals bij alcoholen, fenolen, ethers, koolhydraten, enz., waarvan de formules kunnen worden beschreven met CNHM OFP.
Kan u van dienst zijn: mechanische eigenschappen van metalenDe kenmerken zijn dus zeer gevarieerd en oscilleren in de hoge graad van de ene ternaire verbinding met de andere. De verbinding cNHMOFP Er wordt gezegd dat het geoxygeneerd is; Terwijl cNHMNP, Aan de andere kant is het stikstof (het is een amine). Andere verbindingen kunnen zwavel, gefosforeerd, gefluoriseerd zijn of een duidelijk metaalkarakter hebben.
Bases en zuren
Op het gebied van anorganische chemie heeft je metalen bases, mNOFMHP. Geven.
De NaOH -basis moet bijvoorbeeld, rekening houdend met dergelijke subscripten, als NA worden geschreven1OF1H1 (wat chaotisch zou zijn). Bovendien zou worden aangenomen dat H is als een kation h+, En niet hoe het echt lijkt: deel uitmaken van anion oh-. Vanwege de actie van OH- Op de huid zijn deze bases zepen en bijtend.
De metalen basen zijn ionische stoffen, en hoewel ze bestaan uit twee ionen, mN+ en oh- (NA+ en oh- Voor de NaOH) zijn het ternaire verbindingen voor het hebben van drie verschillende atomen.
Zuren daarentegen zijn covalent en hun algemene formule is hao, waar meestal een niet -metalen atoom is. Gezien het gemak van geïoniseerde in water dat hydrogenen loslaat, zijn H -ionen echter+ Corroen en pijn de huid.
Nomenclatuur
Net als de kenmerken is de nomenclatuur van de ternaire verbindingen zeer gevarieerd. Om die reden zullen alleen de bases, oxoacides en oxisalen worden beschouwd als oppervlakkig.
Honken
Metalen basen worden eerst genoemd met het woord 'hydroxide' gevolgd door de naam van het metaal en zijn valentie in Romeinse getallen tussen haakjes tussen haakjes. Aldus is NaOH natriumhydroxide (I); Maar omdat het natrium een unieke valentie van +1 heeft, blijft het gewoon als natriumhydroxide.
Het kan u van dienst zijn: AlceansDe al (oh)3, Het is bijvoorbeeld aluminium hydroxide (III); en cu (oh)2, koperhydroxide (ii). Natuurlijk allemaal volgens de systematische nomenclatuur.
Oxoacides
Oxóacides hebben een vrij algemene formule van het Hao -type; Maar in werkelijkheid worden ze beter omschreven als AOH. Ha-H's link komt naar voren de H is vrijgegeven+.
De traditionele nomenclatuur is als volgt: het woord 'zuur' begint, gevolgd door de naam van het centrale atoom, voorafgegaan of voorafgegaan door hun respectieve voorvoegsels (hypo, per) of achtervoegsels (bear, ICO) volgens of hij werkt met zijn minderjarigen of oudere valenties.
Broomoxoacides zijn bijvoorbeeld HBRO, HBRO2, Hbro3 en hbro4. Dit zijn zuren: hypobromous, bromic, bromic en perbromisch, respectievelijk. Merk op dat er in allemaal drie atomen zijn met verschillende waarden voor hun subscripties.
Ossen
Ook wel nullion zouten genoemd, ze zijn de meest representatieve van ternaire verbindingen. Het enige verschil om ze te vermelden is dat de beer en ico sufijos veranderen voor respectievelijk ITO en ATO. Ook wordt H vervangen door een metaalkation, product van zuur-base neutralisatie.
Doorgaan met broom, zouden de natriumoxisalen zijn: Nabro, Nabro2, Nabro3 en Nabro4. Hun namen zouden worden: Hipobromito, Bromito, Bromato en Natrium Perbromate. Zonder twijfel overtreft het aantal mogelijke oxisalen dat van oxoacides.
Opleiding
Nogmaals, elk type ternaire verbinding heeft zijn eigen oorsprong of trainingsproces. Het is echter eerlijk om te vermelden dat deze alleen kunnen worden gevormd als er voldoende affiniteit is tussen de drie Atoms -leden. Metalen basen bestaan bijvoorbeeld dankzij elektrostatische interacties tussen kationen en OH-.
Kan u van dienst zijn: citroenzuurIets soortgelijks gebeurt met zuren, die niet konden worden gevormd als er geen dergelijke covalente binding was a-o-h.
Op basis van de vraag, hoe worden de belangrijkste verbindingen gevormd? Het directe antwoord is als volgt:
- Metalen basen worden gevormd door metaaloxiden op te lossen in water of in een alkalische oplossing (meestal geleverd door NaOH of ammoniak).
- Oxoacides zijn het product van het oplossen van niet -metalen oxiden in water; Onder hen, de CO2, Mantel2, NEE2, SW3, P4OF10, enz.
- En dan ontstaan oxisalen wanneer oxoacides worden alkaliseerd of geneutraliseerd met een metaalbasis; Uit het komen de metalen kationen die hvoeren h+.
Andere ternaire verbindingen worden gevormd volgens een meer gecompliceerd proces, zoals bij bepaalde legeringen of mineralen.
Voorbeelden
Ten slotte wordt een reeks formules voor verschillende ternaire verbindingen weergegeven als een lijst:
- Mg (oh)2
- Cr (OH)3
- Kmno4
- NA3Bo3
- CD (OH)2
- Oudere broer3
- Feaso4
- Bacr2OF7
- H2SW4
- H2Teo4
- Hcn
- AGOH
Andere minder gebruikelijke (en zelfs hypothetische) voorbeelden zijn:
- Cofecu
- Algasn
- Ucapb
- Bemgo2
De subscripten N, M en P werden weggelaten om de formules niet te compliceren; Hoewel in werkelijkheid zijn stoichiometrische coëfficiënten (behalve het beste voor de Bemgo2), kan zelfs decimale waarden hebben.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- MEVR. Hilfstein. (S.F.)). Ternary Comunds. Hersteld van: tenafly.K12.NJ.ons
- Wikipedia. (2019). Ternary Comund. Opgehaald uit: in.Wikipedia.borg
- Carmen Bello, Arantxa Isasi, Ana Puerto, Germán Tomás en Ruth Vicente. (S.F.)). Ternaire verbindingen. Hersteld van: IESDMJAC.Onderwijzer.Aragon.is
- « Quaternaire verbindingen Kenmerken, training, voorbeelden
- Speciale verbindingskenmerken, training, gebruik »

