Distributiepartitiecoëfficiënt, distributie, toepassingen
- 891
- 56
- Hugo Crooks
Hij partitie of distributiecoëfficiënt Het wordt gedefinieerd als de reden voor de concentratie van een chemische of opgeloste stof tussen twee middelen in evenwicht. Dit medium kan een gasachtige lucht zijn; een vloeistof zoals water of olie; of een complex mengsel zoals bloed of andere stoffen.
De bloed-/luchtpartitiecoëfficiënt is belangrijk om de gasuitwisseling te verklaren die zich in de longen voordoet, tussen het bloed en de atmosfeer.
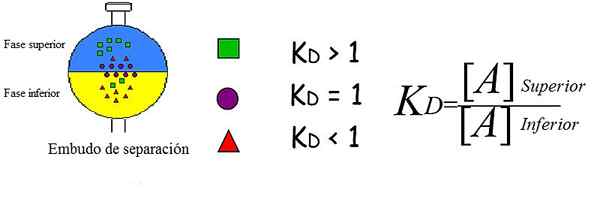
 Diagram waarin de distributiecoëfficiënt wordt uitgelegd voor drie opgeloste stoffen tussen twee fasen. Bron: perdula [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Diagram waarin de distributiecoëfficiënt wordt uitgelegd voor drie opgeloste stoffen tussen twee fasen. Bron: perdula [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Het superieure beeld toont het concept dat op een vereenvoudigde en briljante manier wordt uitgelegd. Elke figuur vertegenwoordigt een analyt, die wordt verdeeld en/of verdeeld tussen twee niet -mengbare fasen: de ene superieur en de andere lager.
Groene vierkanten bevinden zich voornamelijk in de bovenste fase; Terwijl rode driehoeken meer oplossen in de lagere fase, en paarse cirkels ervoor kiezen om zichzelf in de interface te plaatsen.
Het is te zien hoe k varieertD Voor elke analyt. JA KD Het is groter dan 1, de analyt zal meer worden verdeeld over de bovenste fase; Als de waarde bijna 1 is, zal deze de neiging hebben om in de interface te plaatsen; of als daarentegen KD is minder dan 1, zal voornamelijk in de lagere fase zijn.
Een van de vormen van de partitiecoëfficiënt is dat bestaat tussen twee niet -mengbare vloeistoffen in evenwicht; Net als het N-Octaan- en watersysteem. Dit systeem is gebruikt om een belangrijke eigenschap van een verbinding tot stand te brengen: het hydrofobe of hydrofiel karakter ervan.
De waarde van de partitiecoëfficiënt (P) of distributiecoëfficiënt (K) dient om het hydrofobe karakter van een medicijn aan te geven. Het kan dus worden gebruikt om zijn proces van darmabsorptie, verdeling, metabolisme en uitscheiding te voorspellen.
[TOC]
Distributiecoëfficiënt
Definitie
De verdelingscoëfficiënt (k) van een stof, ook wel partitiecoëfficiënt genoemd (P), is de verhouding tussen het delen van de concentraties van een stof in twee fasen; gevormd door het mengsel van twee oplosmiddelen die niet -mengbaar zijn voor het hebben van verschillende dichtheden en aard.
De waarde van de distributiecoëfficiënt (k) of partitie (p) is gerelateerd aan het verschil in drugsoplosbaarheid in niet -mengbare vloeistoffen die deel uitmaken van het mengsel.
K o p = [substantie]1 / [substantie]2
[substantie]1 Het is de concentratie van de stof in vloeistof 1. En [substantie]2 Het is de concentratie van dezelfde stof in vloeistof 2.
Interpretatie
Als k of p een waarde heeft die gelijk is aan 3, geeft dit aan dat de stof 3 keer meer geconcentreerd is in vloeistof 1 dan in vloeistof 2. Maar tegelijkertijd wijst hij er ook op dat de stof meer oplosbaar is in vloeistof 1.
Als de waarde van K of P nu 0,3 is, heeft de stof een grotere concentratie in vloeistof 2; en daarom is de oplosbaarheid ervan in vloeistof 2 ouder dan in vloeistof 1.
Kan u van dienst zijn: een homogeen systeemOctanol/waterpartitiecoëfficiënt
Op sommige gebieden van onderzoek, zoals organische chemie en apotheker, wordt het mengsel van vloeistoffen gevormd door water en een apolaire vloeistof zoals N-octhanol of 1- octanol, dus het wordt meestal genoemd over de octanol partitiecoëfficiënt /water vertegenwoordigd door POW.
De N-octhanol heeft een dichtheid van 0,824 g/cm3; Terwijl het water, zoals bekend, een dichtheid heeft van 1 g/cm3 ongeveer constant. Zodra de twee vloeistoffen in evenwicht zijn geweest, is de N-Octch.
Een hydrofobe stof zal een grotere concentratie in de N-octhanol hebben, zodra de niet-mengbare vloeistoffen in evenwicht zijn. Aan de andere kant zal een hydrofiele stof een grotere concentratie in water hebben.
Beperkingen
De partitie- of distributiecoëfficiënt wordt toegepast op niet -geioniseerde stoffen. In het geval dat de partitiecoëfficiënt wordt gemeten in een ioniseerbare stof, moet de pH of een buffer in de waterige fase worden aangepast om ervoor te zorgen dat de stof wordt gepresenteerd als niet gedissocieerd.
Bij de bepaling van de partitiecoëfficiënt mogen spanning of oppervlakteactieve stoffen niet worden gebruikt, omdat deze stoffen, vanwege hun amfifyllisch karakter, zich bevinden op het grensvlak van niet -mengbare vloeistoffen.
De N-octhanol/waterpartitiecoëfficiënt wordt meestal uitgedrukt in logaritmische vorm; dat wil zeggen, als log p of log van k, vanwege de amplitude van de waarden van p en k.
Als het P -logboek voor een stof groter is dan 0, is dit een indicatie dat de stof hydrofoob is. Integendeel, als het P -logboek minder is dan 0 (dat wil zeggen negatief), geeft dit aan dat de stof hydrofiel is.
Distributiecoëfficiënt (d)
De verdelingscoëfficiënt (d) is het quotiënt tussen de concentratie van alle stoffen, geïoniseerd en niet geïoniseerd, in vloeistof 1 (n -ortanol) en de concentratie van dezelfde stoffen in vloeistof 2 (water).
Zodra de waarde van de verdelingscoëfficiënt (d) is verkregen, kan dit worden uitgedrukt als d -logaritme vanwege de amplitude van de D -waarden.
Om de distributiecoëfficiënt (D) te verkrijgen, moet de waterige fase worden gebufferd; dat wil zeggen tot een bepaalde pH, die moet worden aangegeven wanneer verwezen wordt gemaakt van de waarde van de verkregen verdelingscoëfficiënt.
Kan u dienen: benzeen: geschiedenis, structuur, eigenschappen, derivaten, gebruikHet is handig om D te bepalen bij pH 7,4. Deze pH komt overeen met die van het bloed en vertegenwoordigt de omstandigheden die medicijnen of verbindingen zullen vinden in de intracellulaire omgeving en in de extracellulaire omgeving.
Voor een niet -ioniseerbare verbinding de log d = log p, ongeacht de gebruikte pH.
Experimentele bepaling van een partitiecoëfficiënt
Er zijn verschillende methoden voor partitiecoëfficiëntmeting (P). Onder hen zijn de agitatie -flesmethode en vloeistofchromatografie met hoge resolutie. In zowel een eerdere kennis van de oplosbaarheid van de probleem is de substantie vereist, zowel in de N-octhanol als in water.
Agitatie flesmethode
Het monster wordt opgelost in N-Ectchtanol verzadigd met water, dat in een trechter zal worden uitgevoerd, wordt gescheiden of decantatie met verzadigd water met N-ochanol. De verzadiging van oplosmiddelen is nodig om de overdracht van oplosmiddelen tijdens het partitieproces te voorkomen.
De decantatietrechter wordt gedurende een bepaalde tijd onderworpen aan mechanische agitatie. Dan wordt het lange tijd in rust achtergelaten om een volledige scheiding te garanderen. Om te concluderen, worden de fasen gescheiden door decantatie.
Vervolgens wordt de concentratie van het monster bepaald in elk van de oplosmiddelen met behulp van een spectrofotometrische methode; Bijvoorbeeld UV-zichtbare of andere methode. Ten slotte worden met de verkregen gegevens de partitiecoëfficiënt en de log p berekend.
Deze methode heeft het voordeel dat het economisch, reproduceerbare en hoge precisie is. Kortom, het is de meest betrouwbare methode bij het bepalen van log p.
Het belangrijkste nadeel van de methode is dat deze veel tijd verbruikt: meer dan 24 uur om vloeistoffen, agitatie en scheiding van de fasen tijdens het partitieproces in evenwicht te brengen. Bovendien is het alleen van toepassing op oplosbare stoffen in N-octhanol en water.
Liquidchromatografiemethode met hoge resolutie
De log p met behulp van de correlatie van de retentietijd van het monster kan worden verkregen, met de retentietijd van een vergelijkbare chemische structuurreferentie met een bekende P -waarde.
Het is een methode waarbij de waarde van log p wordt verkregen in een duur van minder dan 20 minuten. Geeft logwaarden tussen 0 en 6, wat alleen overeenkomt met hydrofobe stoffen.
Het nadeel is dat de waarde van P door lineaire regressie wordt bepaald, dus verschillende verbindingen van chemische structuur vergelijkbaar met het monster en van bekende logboeken moeten als referentie worden gebruikt.
Kan u bedienen: Bromine: geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruikToepassingen
Optimalisatie van drugswerking
Als een medicijn wordt ingenomen, moet het het licht van de dunne darm bereiken, waar de meeste stoffen worden geabsorbeerd. Vervolgens kruist het de binnenkant van de cellen en lost het op in de lipidebilaag die deel uitmaakt van het membraan. Dit proces wordt begunstigd door het hydrofobe karakter van het medicijn.
Het medicijn moet door de darmcellen gaan, het basale membraan oversteken om het bloed te bereiken en de doelreceptoren van de drugswerking te bereiken. Sommige fasen van het wereldwijde proces worden begunstigd door het hydrofobe karakter van het medicijn, maar anderen niet.
Er moet een waarde van de partitiecoëfficiënt worden gevonden die alle benodigde processen mogelijk maakt voor de werking van drugs en lichaam goed.
Het gebruik van overmatig hydrofobe geneesmiddelen kan giftig zijn, omdat het metabolisme mogelijk potentieel schadelijke metabolieten kan produceren. Aan de andere kant hebben volledig hydrofiele geneesmiddelen moeite met hun darmabsorptie.
Agrochemische producten
De activiteit van insecticiden en herbiciden wordt beïnvloed door zijn hydrofobe karakter. Hydrofobiciteit wordt echter geassocieerd met een langere halve leven. Daarom is het vervuilende effect op het milieu verlengd, en in staat zijn om ecologische schade te veroorzaken.
Hydrofobe producten die efficiënt werken, met een kortere halve leven moet optreden.
Milieuzorg
Hydrofobe verbindingen zijn meestal verontreinigende stoffen voor het milieu, omdat ze door de grond worden afgevoerd, kunnen grondwater en vervolgens rivierwateren bereiken.
Kennis van de partitiecoëfficiënt van een verbinding, kunnen in zijn chemische structuur veranderingen worden aangebracht die hydrofobiciteit wijzigen om zijn vervuilende werking op het milieu te verminderen.
Hydrogeologie gebruikt de octanol/watergietcoëfficiënt (KOW) om de stroom van hydrofobe verbindingen te regelen, zowel op de grond als in grondwater.
Referenties
- Bannan, c. C., Calabró, g., Kyu, D. EN., & Mobley, D. L. (2016). Het berekenen van partitiecoëfficiënten van kleine moleculen in octanol/water en cyclohexaan/water. Journal of Chemical Theory and Computation, 12(8), 4015-4024. Doi: 10.1021/ACS.JCTC.6B00449
- Wikipedia. (2019). Distributiecoëfficiënt. Hersteld van: is.Wikipedia.borg
- Nationale Universiteit van Colombia. (S.F.)). Unit 8: Experimentele bepaling van de distributiecoëfficiënt van barbituraten. [PDF]. Hersteld van: netwerk.een i.Edu.co
- De Sevier. (2019). Verdelingscoëfficiënt . Wetenschap direct. Opgehaald uit: Scientedirect.com
- SeeBoo Hemnath. (2019). Partitiecoëfficiënt: definitie en berekening. Studie. Hersteld van: studie.com
- « Engelse agrarische revolutie achtergrond, oorzaken, kenmerken
- Hemocultuur Waar is het voor, fundering, procedure, resultaten »

