Loodchloride -eigenschappen, structuur, gebruik

- 4485
- 1055
- Cecil Graham
Hij chloride leiden Het is een anorganisch zout waarvan de chemische formule PBCL isN, Waarbij n het oxidatienummer van de lood is. Dus wanneer de lood is als +2 of +4, is zout PBCL2 of PBCL4, respectievelijk. Daarom zijn er twee soorten chloriden voor dit metaal.
Van de twee, de PBCL2 Het is de belangrijkste en stabiele; Terwijl de PBCL4 is onstabiel en van minder nuttig. De eerste is van ionische aard, waar het kation pb2+ genereert elektrostatische interacties met het cl anion- om een kristallijn netwerk te bouwen; En de tweede is covalent, met PB-CL-links die een lead en chloortetraëder afkomstig hebben.
 Gebraden PBCL2 -naalden. Bron: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Gebraden PBCL2 -naalden. Bron: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Een ander verschil tussen loodchloriden is dat PBCL2 Het is een vaste stof van witte glasvormige kristallen (superieure afbeelding); Terwijl de PBCL4 Het is een geelachtige olie die kan kristalliseren bij -15ºC. PBCL -invoer2 Het is esthetischer dan de PBCL4.
Naast de bovengenoemde, de PBCL2 Het wordt in de natuur gevonden als het Cotunite -mineraal; Terwijl de PBCL4 Nee, omdat het vatbaar is voor ontledingen. Terwijl van PBCL4 Je kunt de PBO krijgen2, van de PBCL2 Ze leiden een eindeloze verscheidenheid aan organomethalische verbindingen af.
[TOC]
Eigenschappen
De eigenschappen van loodchloride hangen af in de essentie van het oxidatienummer van het lood; Sindsdien verandert chloor niet, maar doet de manier waarop het omgaat met lood. Daarom moeten beide verbindingen worden aangepakt; Lood chloride (II) enerzijds en leidchloride (IV) aan de andere kant.
-Loodchloride (ii)
Molaire massa
278.10 g/mol.
Fysiek uiterlijk
Witkleurige kristallen met naaldvormen.
Dikte
5.85 g/ml.
Smeltpunt
501ºC.
Kookpunt
950ºC.
Oplosbaarheid in water
10.8 g/l bij 20ºC. Het is weinig oplosbaar en het water moet worden verwarmd zodat een aanzienlijke hoeveelheid kan worden opgelost.
Het kan u van dienst zijn: nikkelhydroxide (ii): structuur, eigenschappen, gebruik, risico'sBrekingsindex
2.199.
Loodchloride (IV)
Molaire massa
349,012 g/mol.
Fysiek uiterlijk
Geelachtige olieachtige vloeistof.
Dikte
3.2 g/ml.
Smeltpunt
-15ºC.
Kookpunt
50ºC. Bij hogere temperaturen breekt het af met het vrijgeven van gasvormige chloor:
PBCL4(s) => pbcl2(s) + cl2(G)
In feite kan deze reactie erg explosief zijn, dus PBCL wordt opgeslagen4 In zwavelzuur bij -80 ° C.
Structuur
-Loodchloride (ii)
In het begin werd vermeld dat de PBCL2 Het is een ionische verbinding, dus het bestaat uit PB -ionen2+ en Cl- die een kristal bouwen waarin een PB -verhouding wordt vastgesteld: CL gelijk aan 1: 2; Dat wil zeggen, er zijn twee keer zo goed als cl anions- Welke kationen pb2+.
Het resultaat is dat orthorrombische kristallen worden gevormd waarvan de ionen kunnen worden weergegeven met een bollen en stavenmodel zoals in het onderste beeld.
 Cotunietstructuur. Bron: Benjah-bmm27 [Public Domain].
Cotunietstructuur. Bron: Benjah-bmm27 [Public Domain]. Deze structuur komt ook overeen met die van het Cotunite -mineraal. Hoewel de staven worden gebruikt om een directionaliteit van de ionische link aan te geven, moet deze niet worden verward met een covalente (of op zijn minst puur covalente) link).
In genoemde ortorrombische kristallen de PB2+ (Grillian bollen) Het heeft negen Cl- (groene bollen) om hem heen, alsof hij opgesloten was in een driehoekige prisma. Voor het ingewikkelde van de structuur en de lage ionische dichtheid van de PB2+, De moleculen zijn moeilijk om het glas op te lossen; reden waarom het weinig oplosbaar is in koud water.
Gaseous fasemolecuul
Wanneer noch het kristal noch de vloeistof hoge temperaturen kunnen weerstaan, beginnen de ionen te verdampen als PBCL -moleculen2 discreet; dat wil zeggen, met CL-PB-Cl covalente bindingen en een hoek van 98º, alsof het een boemerang is. Er wordt dan gezegd dat de gasfase uit deze PBCL -moleculen bestaat2 en niet van ionen die door luchtstromen worden gedragen.
Kan u van dienst zijn: elektronegativiteitLoodchloride (IV)
Ondertussen, de PBCL4 Het is een covalent verbinding. Omdat? Omdat het kation pb4+ Het is kleiner en heeft ook een grotere ionenbelastingsdichtheid dan de PB2+, die een grotere polarisatie van de elektronische wolk van de CL veroorzaakt-. Het resultaat is dat in plaats van een interactie van het ionische type PB4+Klet-, De pb-cl covalente link wordt gevormd.
Gezien dit, wordt de gelijkenis tussen de PBCL begrepen4 En bijvoorbeeld de CCL4; Beide worden gepresenteerd als tetraëdrische individuele moleculen. Aldus wordt uitgelegd waarom dit loodchloride een geelachtige olie is in normale omstandigheden; De atomen van CL zijn enkele gerelateerd aan elkaar en "glijden" wanneer twee PBCL -moleculen4 Ze komen zich aan.
Wanneer de temperatuur echter daalt en de moleculen langzamer worden, worden de waarschijnlijkheid en effecten van instant dipolen verhoogd (PBCL4 Het is apolair gezien zijn symmetrie); En dan bevriest de olie als gele zeshoekige kristallen:
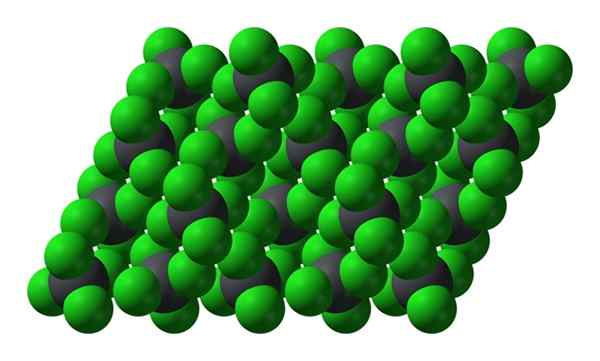 Kristallijne structuur van PBCL4. Bron: Benjah-bmm27 [Public Domain]
Kristallijne structuur van PBCL4. Bron: Benjah-bmm27 [Public Domain] Merk op dat elke grijsfeer is omgeven door vier groene bollen. Deze PBCL -moleculen4 "SQUERED" vormen een onstabiel kristal en vatbaar voor het ontbinden van krachtig.
Nomenclatuur
De namen: loodchloride (II) en loodchloride (iv) komen overeen met die toegewezen volgens de voorraadnomenclatuur. Omdat het oxidatienummer +2 de kleinste is voor lood, en +4 de grootste, kunnen beide chloriden worden genoemd volgens de traditionele nomenclatuur als plumbosechloride (PBCL2) en plúbic chloride (PBCL4), respectievelijk.
En ten slotte is de systematische nomenclatuur, die het aantal van elk atoom van de verbinding benadrukt. Dus de PBCL2 Het is looddichloride en pbcl4 Lood tetrachloride.
Het kan u van dienst zijn: chemische ondoordringbaarheidToepassingen
Een praktisch gebruik voor PBCL is niet bekend4 Naast het dienen van PBO -synthese2. De PBCL2 Het is nuttiger en daarom worden slechts enkele toepassingen voor dit specifieke leadchloride hieronder vermeld:
- Vanwege de zeer luminescerende aard is het bestemd voor fotografische, akoestische, optische en stralingsdetectoren.
- Niet absorberen in het infraroodspectrumgebied, wordt het gebruikt voor de productie van glas dat dit type straling doorbrengt.
- Hij maakte deel uit van wat zij het Aureno -glas noemen, een aantrekkelijk materiaal van iriserende blauwachtige kleuringen die worden gebruikt voor sierdoeleinden.
- Ook, volgens het thema van kunst, wanneer je wordt bereikt, pbcl2· PB (OH)2 Verwerft intense witachtige tinten, met behulp van wit loodpigment. Het gebruik ervan is echter ontmoedigd vanwege de hoge toxiciteit.
- Gesmolten en gemengd met bariumtitanaat, Batio3, ontstaat het Titanato -keramiek van Barium en Lood BA1 - XPBXOom3. Als een PB2+ Voer de Batio in3, Een BA2+ U moet het glas verlaten om de oprichting toe te staan, en er wordt vervolgens gezegd dat er een kationuitwisseling plaatsvindt; Dat is de reden waarom de samenstelling van de BA2+ Het wordt uitgedrukt als 1-x.
- En tot slot, van PBCL2 Verschillende organomethalische verbindingen van algemene formule rumula zijn gesynthetiseerd r4PB of R3PB-PBR3.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Lood (ii) chloride. Opgehaald uit: in.Wikipedia.borg
- Chemische formulering. (2019). Loodchloride (IV). Hersteld van: Quimica -formulering.com
- Clark Jim. (2015). De chloriden van koolstof, silicium en lood. Hersteld van: chemguide.co.Uk
- Spectrale en optische niet -lineaire studies naar loodchloride (PBCL2) Kristallen. [PDF]. Hersteld van: Shodhganga.Infibnet.AC.in
- Nationaal centrum voor biotechnologie -informatie. (2019). Chloride leiden. PubChem -database; CID = 24459. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- « Mangaanchloride -eigenschappen, structuur, gebruik, risico's
- Conversie kost hoe berekend en voorbeelden »

