Mangaanchloride -eigenschappen, structuur, gebruik, risico's

- 2565
- 529
- Aaron Okuneva
Hij mangaanchloride Het is een anorganisch zout waarvan de chemische formule MCL is2. Het bestaat uit Mn -ionen2+ en Cl- in een verhouding van 1: 2; Voor elk kation mn2+ Er zijn twee keer van cl anions-.
Dit zout kan verschillende hydraten vormen: mncl2· 2H2Of, (dihydraat), mcl2· 4h2Of (tetrahydraat) en mcl2· 6h2Of (hexahydraat) de meest voorkomende vorm van zout is tetrahydraat.
 Roze mangaanchloride kristallen. Bron: Ondřej Mangl [Public Domain]
Roze mangaanchloride kristallen. Bron: Ondřej Mangl [Public Domain] De fysische eigenschappen van mangaanchloride zoals dichtheid, smelten en oplosbaarheidspunt in water, worden beïnvloed door hun mate van hydratatie. Het smeltpunt van anhydra -vorm is bijvoorbeeld veel groter dan dat van de tetrahydraatvorm.
De kleur van mangaanchloride is lichtroze (superieur beeld). Taalheid is kenmerkend voor overgangsmetalen zouten. Mangaanchloride is een zwak Lewis -zuur.
Het mineraal dat bekend staat als Escacquita is de natuurlijke watervrije vorm van mangaanchloride (II); Zoals de Kempita.
Mangaanchloride (II) wordt gebruikt als een legeringsagent; Katalysator in chlorinatiereacties, enz.
[TOC]
Fysieke eigenschappen
Fysiek uiterlijk
- Anhydra -vorm: roze kubieke kristallen.
- Tetrahydraatvorm: enigszins delicate roodachtige monokliene kristallen.
Molaire massa's
- Anhidro: 125.838 g/mol.
- Dihydrared: 161.874 g/mol.
- Tetrahydraat: 197,91 g/mol.
Fusiepunten
- Anhidro: 654 ºC.
- Dihydrared: 135 ºC.
- Tetrahydraat: 58 ºC.
Kookpunt
Anhidra -vorm: 1.190 ºC.
Dichtheden
- Watervrij: 2.977 g/cm3.
- Dihydrared: 2,27 g/cm3.
- Tetrahydraat: 2.01 g/cm3.
Oplosbaarheid in water
Anhydra -vorm: 63,4 g/100 ml bij 0 ºC; 73,9 g/100 ml bij 20 ºC; 88,5 g/100 ml bij 40 ° C; en 123,8 g/100 ml bij 100 ° C.
Oplosbaarheid in biologische oplosmiddelen
Oplosbaar in pyridine en ethanol, onoplosbaar in ether.
Ontleding
Tenzij de juiste voorzorgsmaatregelen worden genomen, kan uitdroging van gehydrateerde vormen tot watervrijvorm hydrolytische uitdroging veroorzaken, met de productie van waterstofchloride en mangaanoxychloride.
pH
Een 0,2 m oplossing van tetrahydraatmangaanchloride in waterige oplossing heeft een pH van 5,5.
Kan u van dienst zijn: chromatogramStabiliteit
Het is stabiel, maar gevoelig voor vocht en onverenigbaar met sterke zuren, reactieve metalen en waterstofperoxide.
Mangaanchloride structuur
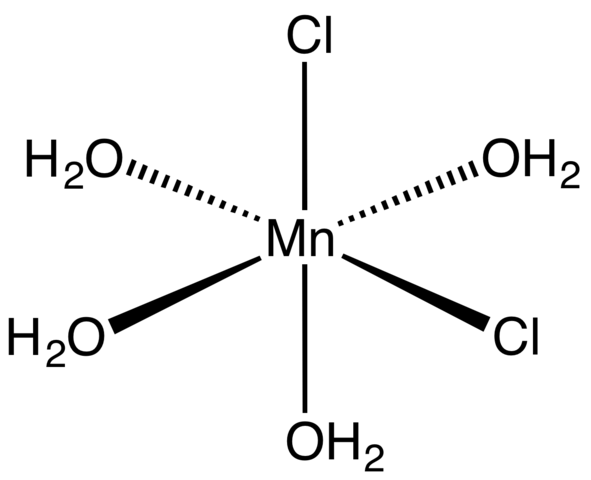 Coördinatiecomplex voor MNCL2 -tetrahydraat. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Coördinatiecomplex voor MNCL2 -tetrahydraat. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Beginnend met tetrahydraatzout, roze en opvallende kristallen, moet het bestaan uit coördinatiecomplexen (superieur beeld). In hen, het MN Metallic Center2+ wordt omgeven door een octaëder gedefinieerd door vier H -moleculen2Of en twee cl anions-.
Merk op dat CL Ligands- Ze bevinden zich in CIS -posities; Allen zijn equivalent in de rechthoekige basis van de octaedro, en het maakt niet uit of de CL "verplaatst" is- aan een van de andere drie posities. Een ander mogelijk isomeer voor dit gecoördineerde molecuul is waarin beide Cl- Ze bevinden zich in transposities; dat wil zeggen, aan verschillende uiteinden (de een hierboven en de andere hieronder).
De vier watermoleculen met hun waterstofbruggen laten twee of meer octaëder toe om zich aan te sluiten bij dipool-Dipolo-krachten. Deze bruggen zijn zeer directioneel en voegt de elektrostatische interacties tussen de MN toe2+ en Cl-, Ze vestigen een geordende structuur die kenmerkend is voor een kristal.
De roze kleur van de MNCL2· 4h2Of is te wijten aan de elektronische overgangen van de MN2+ en de D -configuratie5. Evenzo wijzigen de verstoringen veroorzaakt door de buurt van de watermoleculen en de chloriden de noodzakelijke hoeveelheid energie die dergelijke elektronen moeten absorberen5 Om hogere energieniveaus te reizen.
Dihydraat
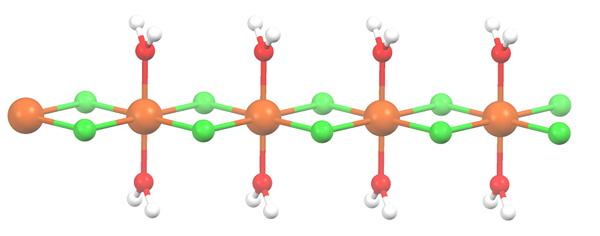 Polymere structuur voor MnCl2 · 2H2O. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Polymere structuur voor MnCl2 · 2H2O. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Zout is uitgedroogd en zijn formule wordt nu MCL2· 2H2OF. Wat gebeurt er met de voorste octaëder? Niets, behalve dat de twee H -moleculen2Of dat ze verlaten worden vervangen door twee CL-.
In het begin kunt u de verkeerde indruk wekken dat er vier CL zijn- Voor elke Mn2+; De helft van de octaëder (axiaal) is echter eigenlijk de repetitieve eenheid van het glas.
Het is dus waar dat er een MN is2+ gecoördineerd op twee CL- en twee watermoleculen in transposities. Maar om deze eenheid met een ander te communiceren, heeft het twee CL -bruggen nodig, waardoor de coördinatie octaëder het mangaan kan voltooien.
Kan u van dienst zijn: diatomee elementenNaast de CL -bruggen werken watermoleculen ook samen met hun waterstofbruggen zodat deze MNCL -keten2· 2H2Of ontwapenen niet.
Watervrij
Ten slotte is magnesiumchloride klaar met het verliezen van al het water in zijn kristallen; Je hebt nu anhydra -zout, mcl2. Zonder de watermoleculen verliezen de kristallen de intensiteit van hun roze kleuringen aanzienlijk. De octaëder, wat betreft hydraten, blijft ongewijzigd door de mangaan -aard zelf.
Zonder watermoleculen, de MN2+ uiteinden omringd door een octaëder die alleen uit CL is samengesteld-. Deze coördinatielink heeft zowel covalent als ionisch karakter; Om deze reden verwijst het meestal naar de structuur van de MNCL2 Als een polymeerkristal. Daarin zijn er alternatieve lagen van Mn en Cl.
Nomenclatuur
Mangaan heeft veel mogelijke oxidatietoestanden. Daarom is de traditionele nomenclatuur voor de MNCL2 Het is niet verduidelijkt.
Aan de andere kant komt het mangaanchloride overeen met zijn bekendste naam, waaraan het zou ontbreken om de '(ii)' toe te voegen, zodat het volgens de nomenclatuurvoorraad is: mangaanchloride (ii). En asçi, is de systematische nomenclatuur: mangaan dichloride.
Toepassingen
Laboratorium
Mangaanchloride dient als een katalysator voor chlorering van organische verbindingen.
Industrie
Mangaanchloride wordt gebruikt als grondstof voor de uitwerking van anti -artisantes voor benzine; lasmateriaal voor niet -ferrometalen; intermediair in pigmenten uitwerking; En Linaza -oliedrank.
Het wordt in de textielindustrie gebruikt voor afdrukken en geverfd; bij de productie van verschillende mangaanzouten, waaronder de tricarbonil van methylciclopentadienilmanganese gebruikt als bakstenen kleurstof; en bij de productie van gedroogde elektrische batterijen.
Mangaanchloride wordt gebruikt als een legeringsmiddel en wordt toegevoegd aan het gesmolten magnesium om legeringen van mangaanmagnesium te produceren; als tussenpersoon bij de voorbereiding van droogmiddelen voor schilderen en vernis; en als onderdeel van desinfectiemiddelen.
Kan u dienen: natriumhydroxide (NaOH): structuur, eigenschappen, gebruik, syntheseHet wordt ook gebruikt in magnesiumzuivering.
Kunstmest en diervoeder
Mangaanchloride wordt gebruikt als een bron van mangaan, element, dat, hoewel geen primair voedingselement voor planten zoals stikstof, fosfor en kalium, wordt gebruikt in tal van biochemische reacties van deze levende wezens van deze levende wezens.
Het draagt ook bij aan het voer van fokdieren voor het aanbod van mangaan, een essentiële oligoement voor de groei van dieren.
Mangaanchloride is een voedingscomponent die mangaan levert, een element dat tussenbeide komt in talloze processen die nodig zijn voor het leven, waaronder: synthese van vetzuren en geslachtshormonen; Assimilatie van vitamine E; kraakbeenproductie; enz.
Risico's
Het kan produceren door contact met huid roodheid, irritatie en langdurige blootstellingsdermatitis. Mangaanchloride veroorzaakt roodheid, pijn en traan.
Door inademing de zout veroorzaakt, keelpijn en gebrek aan ademhaling. Aan de andere kant kan inname voorkomen dat braken, misselijkheid en diarree.
Overmatige chronische inademing van dit zout kan leiden tot longontsteking en daaropvolgende reactieve ziekte van de luchtwegen.
De overmatige inname kan psychische stoornissen, uitdroging, hypotensie, lever- en nierfalen, multiorgan systeemfalen en overlijden veroorzaken.
Neurotoxiciteit is de eerste manifestatie van de ongewenste werking van mangaan, in staat zijn hoofdpijn, duizeligheid, geheugenverlies, hyperreflexie en milde tremor te presenteren.
Ernstige toxiciteit wordt gemanifesteerd door symptomen en tekenen vergelijkbaar met die waargenomen bij de ziekte van Parkinson.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Mangaan (II) chloride. Opgehaald uit: in.Wikipedia.borg
- Sky Spring Nanomaterials. (2016). Mangaanchloridepoeder. Hersteld van: ssnano.com
- Chemisch boek. (2017). Chloride mangaan. Hersteld van: chemisch boek.com
- Gegevensnetwerk voor toxicologie. (S.F.)). Chloride mangaan. Toxet. Hersteld van: toxnet.NLM.NIH.Gov
- Gérard Cahiez. (2001). Mangaan (II) chloride. doen.org/10.1002/047084289x.RM020
- Nationaal centrum voor biotechnologie -informatie. (2019). Mangaan dichloride. PubChem -database. CID = 24480. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Webconsultas Healthcare, s.NAAR. (2019). Mineralen: Mangaan. Hersteld van: Web Consultas.com

