IJzerchloride (III) structuur, eigenschappen, verkrijgen, gebruik
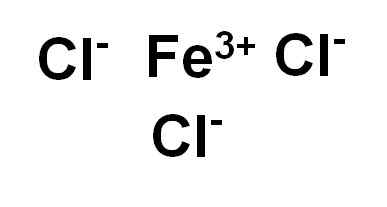
- 4460
- 975
- Ernesto McKenzie
Hij ijzerchloride (iii) Het is een anorganische verbinding gevormd door het ijzer (geloof) en chloorelementen (CL). De chemische formule is fecl3. Het is een kristallijne vaste stof waarvan de kleur van oranje tot zwartachtig bruin kan zijn.
De fecl3 Het wordt gemakkelijk opgelost in water die zure waterige oplossingen vormt, waarbij door de pH te verhogen waardoor ze meer alkalisch zijn.
 IJzerchloride (III) of ijzerchloride fecl3 stevig. Егор осин/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
IJzerchloride (III) of ijzerchloride fecl3 stevig. Егор осин/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. IJzerchloride (III) wordt gebruikt om de deeltjes te sedimenteren die gemeentelijk of industrieel afvalwater vervuilen. Er wordt gezegd dat het u in staat stelt enkele parasieten te verwijderen en te dienen om bloedverliezen van dieren bij dieren te stoppen en voor de genezing hiervan.
Het dient om koper (II) van kopersulfide -mineralen te extraheren. Het wordt ook gebruikt in verschillende chemische reacties en analyse van biologische en chemische laboratoria. Het dient bijvoorbeeld om verbindingen te detecteren als fenolen in oliën die uit planten zijn geëxtraheerd. Het wordt gebruikt in elektronische circuits, in de lederen leerlooier en in fotografie.
Omdat hij de Fecl is3 Een zure verbinding is corrosief voor huid- en slijmvliezen. Het stof van deze verbinding moet worden vermeden. Het mag niet worden weggegooid naar het milieu.
[TOC]
Structuur
IJzerchloride (III) of ijzerchloride fecl3 Het is een ionische verbinding en wordt gevormd door een ijzersterkte3+ en drie ionen chloride cl-. IJzer zit in zijn oxidatietoestand van +3 en elk chloor heeft Valencia -1.
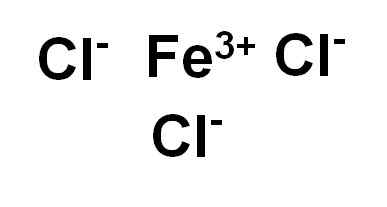 IJzerchloride (III) of ijzerchloride. Auteur: Marilú Stea.
IJzerchloride (III) of ijzerchloride. Auteur: Marilú Stea. Nomenclatuur
- IJzerchloride (iii)
- IJzerchloride
- IJzertrichloride
- Iron Muriature
Eigenschappen
Fysieke staat
Kristallijn vaste sinaasappel tot zwartachtig bruin.
 Ferrische chloride fecl3 watervrij (zonder water). Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Ferrische chloride fecl3 watervrij (zonder water). Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Molecuulgewicht
Anhidro fecl3 = 162.2 g/mol
Smeltpunt
Anhidro fecl3 = 304 ºC
Hexahydraat fecl3 •6h2O = 37 ° C
Kookpunt
Anhidro fecl3 = Ongeveer 316 ºC
Hexahydraat fecl3 •6h2O = 280-285 ° C
Dikte
Anhidro fecl3 = 2,90 g/cm3 bij 25 ° C
Oplosbaarheid
Zeer oplosbaar in water: 74,4 g/100 g water bij 0 ° C; 535,7 g/100 g water bij 100 ° C. Zeer oplosbaar in aceton, ethanol, ether en methanol. Zwak oplosbaar in niet -polaire oplosmiddelen zoals benzeen en hexaan.
Kan u van dienst zijn: BORON: Geschiedenis, eigenschappen, structuur, gebruikpH
De waterige oplossingen zijn erg zuur. Een oplossing van 0,1 mol FECL3 per liter water heeft een pH van 2,0.
Chemische eigenschappen
Wanneer de FADL oplost in water3 Het is gehydrolyseerd; dat wil zeggen, het scheidt in zijn geloofsionen3+ en 3 Cl-. Vertrouwen3+ Vorm het hexaacuohierro -ionen [geloof (h2OF)6]3+ Maar dit wordt gecombineerd met OH -ionen- van het water dat gemengde soorten vormt en protonen vrijgeeft h+.
Om deze reden zijn hun oplossingen zuur. Als de pH toeneemt, vormen deze soorten een gel en uiteindelijk wordt een neerslag of vaste stof van gehydrateerd ferrisch oxide -geloof gevormd2OF3 •NH2OF.
IJzerchloridekristallen (III) zijn hygroscopisch, dat wil zeggen, ze absorberen water uit de omgeving. Als het nat is, is het corrosief voor aluminium en veel metalen.
 Fecl -oplossingen3 Ze kunnen erg zuur en corrosief zijn, omdat ze HCl bevatten. Kanesskong/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Fecl -oplossingen3 Ze kunnen erg zuur en corrosief zijn, omdat ze HCl bevatten. Kanesskong/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Fecl waterige oplossingen3 Ze zijn erg zuur en corrosief voor de meeste metalen. Ze hebben een zwakke geur van HC1 -zoutzuur. Wanneer de Fecl wordt verwarmd tot zijn ontleding3 Zorgt zeer giftige HCl -gassen.
Het verkrijgen van
IJzerchloride (III) wordt geproduceerd door directe chlorering van ijzer door het reageren van droog chloor (CL2) Met ijzerschroot (geloof) bij 500-700 ° C.
De reactie wordt uitgevoerd in een zuur -resistente reactor. De eerste stap is om bij 600 ° C te smelten een mengsel van ijzerchloride (III) (FECL3) en kaliumchloride (KCL).
 De fecl3 Het moet worden bereid in containers die zeer resistent zijn tegen zuren zoals roestvrij staal. Auteur: Johannes Plenio. Bron: Pixabay.
De fecl3 Het moet worden bereid in containers die zeer resistent zijn tegen zuren zoals roestvrij staal. Auteur: Johannes Plenio. Bron: Pixabay. Dan wordt het ijzeren schroot (geloof) opgelost in dat gesmolten mengsel waar ijzer reageert met de fecl3 En het wordt ferro chloride (fecl2)).
Fe + 2 Fecl3 → 3 Fecl2
Dan de fecl2 reageert met chloor Cl2 De Fecl vormen3 die sublimeert (overgaat van de vaste toestand naar de gasvorming rechtstreeks) en wordt verzameld in speciale condensatiekamers.
2 fecl2 + Klet2 → 2 fecl3
U kunt ook ferro feso -sulfaat reageren4 met chloor CL2.
Hexahydraat fecl3 •6h2O Het kan worden verkregen door een waterige oplossing van geloofsionen te verdampen3+ en Cl- In een stoombad.
Kan u van dienst zijn: Quaternaire verbindingen: kenmerken, training, voorbeeldenAanwezigheid in de natuur
IJzerchloride of ijzerchloride (III) wordt gevonden in de vorm in de vorm van het mo -minerale mineraal, dat wordt gevonden in de lava van actieve vulkaan fumarolen. Onder de vulkanen waar u kunt vinden, is Mount Vesubio.
 De fecl3 Het maakt deel uit van het moysite erts dat zich in actieve vulkanen bevindt. Auteur: Skze. Bron: Pixabay.
De fecl3 Het maakt deel uit van het moysite erts dat zich in actieve vulkanen bevindt. Auteur: Skze. Bron: Pixabay. Toepassingen
Bij afvalwaterbehandeling
IJzerchloride wordt gebruikt om gemeentelijk of industrieel afvalwater te behandelen door chemische sedimentatie.
Het fungeert als een stollingsmaatschappij die de vereniging van verschillende deeltjes met elkaar bevordert, op deze manier worden conglomeraten of grotere deeltjes gevormd die de neiging hebben om te vlokken of sediment (hun eigen gewicht verlagen naar de bodem van het water dat wordt behandeld).
 De fecl3 Het wordt gebruikt om ongewenste materialen te scheiden van de wateren die zijn weggegooid door gemeenschappen of industrieën. Auteur: 后园 卓. Bron: Pixabay.
De fecl3 Het wordt gebruikt om ongewenste materialen te scheiden van de wateren die zijn weggegooid door gemeenschappen of industrieën. Auteur: 后园 卓. Bron: Pixabay. Op deze manier wordt de scheiding van water vaste stoffen begunstigd en dit is vrij van ongewenste materialen.
Dit type behandelingen kan de verwijdering van parasieten, zoals protozoa, vergemakkelijken, die micro -organismen zijn gevormd door een enkele cel, zoals Amibas, die ziekte veroorzaken.
Om deze reden de FECL3 Het wordt ook gebruikt om water te zuiveren.
In veterinaire genezingsprocedures
IJzerchloride (III) wordt gebruikt om dierenletsels te genezen.
Het dient als een lokaal samentrekkend (je kunt weefsels intrekken en fungeren als ontstekingsremmende en genezing) en hemostatisch (het stopt met bloeden of bloedverliezen).
Het wordt gebruikt in poeders om bloedverliezen te stoppen of wanneer de paarden tot vee zijn gesneden. Het wordt ook gebruikt in een oplossing om te stoppen met bloeden wanneer klauwen worden gesneden of wratten worden geëlimineerd.
 De fecl3 Het wordt gebruikt in poeders die worden toegepast op de koeien gesneden hoorns en vermijd infecties. Auteur: Jaclou DL. Bron: Pixabay.
De fecl3 Het wordt gebruikt in poeders die worden toegepast op de koeien gesneden hoorns en vermijd infecties. Auteur: Jaclou DL. Bron: Pixabay. Het wordt ook gebruikt om faryngitis (farynx -ontsteking) of stomatitis (ontsteking van het orale slijmvlies) te behandelen en bij sommige vogels bloedhemoglobine te verhogen.
In metaalextractie
IJzerchloride (III) of ijzerchloride fecl3 Het wordt gebruikt om koper (II) van kopererts te extraheren met sulfiden van genoemde metaal.
Kan u van dienst zijn: hydroxidenHet is een oxidatieve methode die voldoende is om de afgifte van giftige gasdioxide te voorkomen (dus2), omdat in plaats daarvan wordt gegenereerd zwavel (s). Oplossingen met hoge FECL -concentraties worden geproduceerd2, Fecl3, CUCL2 en andere metalen chloriden.
4 Fecl3 + Cu2S ⇔ 4 fecl2 + 2 CUCL2 + S ↓
Als een reagens van chemische en biologische laboratoria
Onder veel van zijn chemie wordt gebruikt om de aanwezigheid van de fenolische groep aan te geven (dat wil zeggen groep -oh bevestigd aan een benzeenring).
De verbinding wordt opgelost om te worden geanalyseerd in ethanol en er worden een paar druppels Fecl -oplossing toegevoegd3. Wanneer de verbinding een groep -oh heeft bevestigd aan een benzeenring (dat wil zeggen, het is een fenol) wordt een blauwachtige groene kleuring gevormd.
Deze test maakt het mogelijk om de aanwezigheid van fenolen in plantenextracten te analyseren.
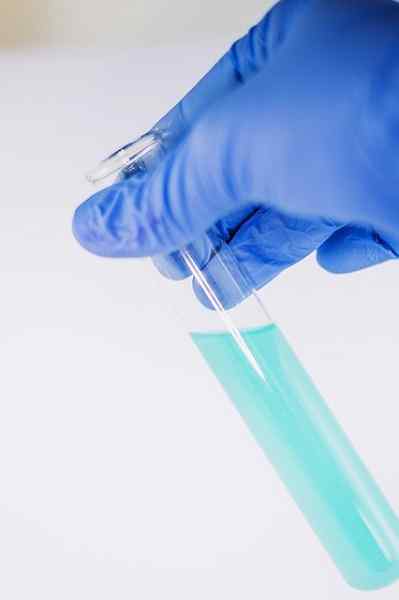 De fecl3 In aanwezigheid van fenolen geeft het een blauwachtige groene kleuring. Auteur: Ewa Urban. Bron: Pixabay.
De fecl3 In aanwezigheid van fenolen geeft het een blauwachtige groene kleuring. Auteur: Ewa Urban. Bron: Pixabay. Het wordt ook gebruikt in tests om de antioxiderende activiteit te bepalen van bepaalde oliën die uit groenten zijn geëxtraheerd.
Een andere van de toepassingen is dat het mogelijk is om andere chemische verbindingen voor te bereiden. Het kan ook fungeren als een oxiderend, chlorinerend middel (levert chloor) en condensor (om twee of meer moleculen met elkaar samen te voegen).
Het dient ook als katalysator of versneller van organische chemische reacties.
In verschillende toepassingen
Ferrisch chloride wordt gebruikt in gedrukte elektronische circuits. Door de kleuring van zijn verschillende gehydrateerde vormen dient het als een pigment en wordt het gebruikt in de lederen leerlooier.
 De fecl3 Het wordt gebruikt bij lederen zonnebank. Auteur: Pexels. Bron: Pixabay.
De fecl3 Het wordt gebruikt bij lederen zonnebank. Auteur: Pexels. Bron: Pixabay. Het is desinfectiemiddel. Het wordt gebruikt om huidaandoeningen te behandelen en wordt ook in fotografie gebruikt.
Risico's
Fecl poeder3 Het is irritant voor de ogen, neus en mond. Als inademing hoest of ademhalingsproblemen veroorzaken. Het is een corrosieve verbinding, dus langdurig contact met de huid en met de ogen of slijmvliezen kunnen roodheid en brandwonden veroorzaken.
Het is niet ontvlambaar, maar wanneer verwarmd bij hoge temperaturen produceert HCl -waterstofchloridegas, dat giftig en zeer corrosief is.
De fecl3 Het is schadelijk voor water- en landorganismen. Als het per ongeluk wordt weggegooid naar het milieu, moet de zuurgraad met basisverbindingen worden geneutraliseerd.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). IJzerchloride. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Kirk-othmer (1994). Encyclopedie van chemische technologie. Deel 19. Vierde druk. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. Deel A22. VCH VerlagSgellschaft MBH.
- Ngameni, b. et al. (2013). Flavonoïden en gerelateerde verbindingen uit de medicinale planten van Afrika. Karakterisering van flavonoïden in plantenextracten. Ferrische chloridetest. In medicinale plantenonderzoek in Afrika. Hersteld van Scientedirect.com.
- Agyare, c. et al. (2017). Petroselinum Crispum: een recensie. Antioxidante werking. In medicinale spartes en groenten uit Afrika. Hersteld van Scientedirect.com.
- Stott, r. (2003). Lot en gedrag van parasieten in afvalwaterzuiveringssystemen. Chemisch geassisteerde sedimentatie. In Handbook of Water and Dastewater Microbiology. Hersteld van Scientedirect.com.
- Tasker, p.NAAR. et al. (2003). Toepassingen van coördinatiechemie. Extractie van CuII Van chloride -oplossingen. Bij het begrijpen van coördinatiechemie. Hersteld van Scientedirect.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- « +125 korte en populaire uitspraken [met betekenis]
- 95 uitspraken en zei Venezolanen en hun betekenis »

