Chrome chloride (Crcl3) structuur, eigenschappen, gebruik

- 945
- 144
- Hugo Crooks
Hij Chrome chloride (CRCL3)) Het is een anorganisch zout bestaande uit crations3+ en cl anions- in een 1: 3 aandeel; dat wil zeggen, voor elke CR3+ Er zijn drie Cl-. Zoals later zal worden gezien, zijn hun interacties niet ionisch. Dit zout kan in twee vormen voorkomen: Anhydra en hexahydraat.
De watervrije vorm wordt gekenmerkt door een violet-rode kleur te presenteren; Terwijl hexahydraat, crcl3.6h2Of het is donkergroen. De opname van watermoleculen wijzigt de fysische eigenschappen van deze kristallen; als zijn kook- en fusiepunten, dichtheden, enz.
 Violet-rivierkristallen van chroomchloride (III) watervrij. Bron: Ben Mills [Public Domain]
Violet-rivierkristallen van chroomchloride (III) watervrij. Bron: Ben Mills [Public Domain] Chrome chloride (III) (volgens de voorraadnomenclatuur) ontleedt bij hoge temperaturen en wordt chrome chloride (II), CRCL2. Het is corrosief voor metalen, hoewel het in het chroom wordt gebruikt: procedure waarin metalen zijn bedekt met een dunne chroomlaag.
De Cr3+, Afkomstig uit het respectieve chloride, is het gebruikt bij de behandeling van diabetes, vooral bij patiënten met totale parenterale voeding (TPN), die de vereiste hoeveelheid chroom niet innemen. De resultaten zijn echter veel beter (en betrouwbaarder) als het wordt geleverd als een picolinato.
[TOC]
Chrome chloridestructuur
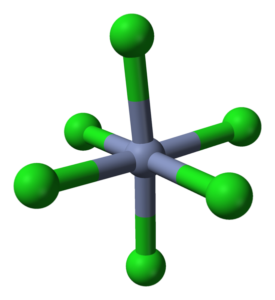 Octaedro -coördinatie voor Crcl3 in zijn kristallen. Bron: Ben Mills [Public Domain]
Octaedro -coördinatie voor Crcl3 in zijn kristallen. Bron: Ben Mills [Public Domain] De CRCL3 Ondanks dat het een zout is, is de aard van hun interacties niet puur ionisch; Ze hebben een bepaald covalent karakter, product van de coördinatie tussen CR3+ en Cl-, die aanleiding geven tot een vervormde octaëder (superieure afbeelding). Het chroom bevindt zich in het midden van de octaedro en de chloors op zijn hoekpunten.
De octaëder CRCL6 U kunt op het eerste gezicht de CRCL -formule tegenspreken3; Deze complete octaëder definieert echter niet de eenheidscel van het glas, maar een kubus (ook vervormd), die de groene bollen of chlooranionen in de helft snijdt.
Kan u van dienst zijn: 20 voorbeelden van chemische sublimatie en kenmerkenKristallijne lagen watervrij
Aldus blijft de unitaire cel met deze octaedro het aandeel 1: 3 handhaven. Het CRCL -kristal reproduceert deze vervormde kubussen in de ruimte en wordt verkregen3, die wordt weergegeven in het superieure beeld met een drie -dimensionaal vulmodel en een model van bollen en bars.
 Crcl3 -kristalstructuurlaag weergegeven met een drie -dimensionale bollen en stavenmodel. Bron: Ben Mills [Public Domain]
Crcl3 -kristalstructuurlaag weergegeven met een drie -dimensionale bollen en stavenmodel. Bron: Ben Mills [Public Domain] Deze kristallijne laag is een van de vele die maken3 (Verwar de kleur van het glas niet, waar, met die van de groene bollen).
Zoals te zien is, de cl anions- Ze bezetten het oppervlak, zodat hun negatieve belastingen de andere kristallijne lagen afstoten. Bijgevolg worden de kristallen oplichter en kwetsbaar; Maar briljant, vanwege Chrome.
Als deze zelfde lagen vanuit een lateraal perspectief worden gevisualiseerd, wordt het waargenomen, in plaats van octaëder, vervormde tetraheders:
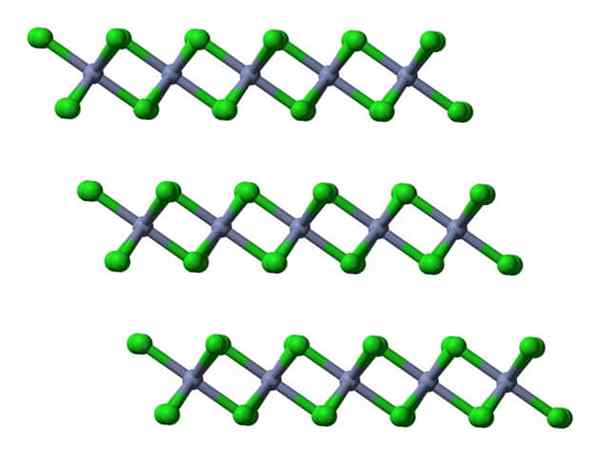 Crcl3 kristallijne lagen aanzichten lateraal. Bron: Ben Mills.
Crcl3 kristallijne lagen aanzichten lateraal. Bron: Ben Mills. Hier wordt het begrip van waarom de lagen met elkaar afgestoten worden gefaciliteerd wanneer de CL- van zijn oppervlakken.
Eigenschappen
Namen
-Chrome chloride (III)
-Chrome trichloride (III)
-Chromen chloride (III) watervrij.
Chemische formule
-CRCL3 (watervrij).
-CRCL3.6h2O (hexahing).
Molecuulgewicht
-158.36 g/mol (watervrij).
-266.43 g/mol (hexahydraat).
Fysieke beschrijving
-Solid en violet-redistische kristallen (watervrij).
-Donkergroen kristallijn stof (hexahydraat, lager beeld). In dit hydraat kan het worden gezien als water remt helderheid, metaalchrome kenmerk.
 Hexahydraat chroom chroom. Bron: Gebruiker: Walkerma [Public Domain]
Hexahydraat chroom chroom. Bron: Gebruiker: Walkerma [Public Domain] Smeltpunt
-1.152 ºC (2.106 ºF, 1.425 K) (Anhydrum)
-83 ºC (hexahydraat).
Kookpunt
1300 ºC (2.370 ºF, 1.570) (Anhydrum).
Oplosbaarheid in water
 Waterige oplossingen van chroomchloride (III). Bron: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Waterige oplossingen van chroomchloride (III). Bron: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] -Enigszins oplosbaar (Anhydro).
-585 g/l (hexahydraat).
In de bovenste afbeelding wordt een reeks testbuizen gevuld met een waterige oplossing van CRCL getoond3. Merk op dat hoe meer geconcentreerd, hoe intenser de kleur van het complex [Cr (OH2))6]3+, Groene kleur verantwoordelijk.
Kan u dienen: putrescina: structuur, eigenschappen, synthese, gebruikOplosbaarheid in biologische oplosmiddelen
Oplosbaar in ethanol, maar onoplosbaar in ether (watervrij).
Dikte
-2,87 gr/cm3 (watervrij).
-2,76 g/cm3 (Hexahydraat).
Bewaar temperatuur
Ontleding
Wanneer verwarmd tot ontleding, straalt chroomchloride (III) giftige dampen uit van verbindingen die chloor bevatten. Deze verbindingen worden ook vrijgegeven wanneer chroomchloride (III) in contact komt met sterke zuren.
Corrosie
Het is zeer corrosief en kan bepaalde staals aanvallen.
Reacties
Het is onverenigbaar met sterke oxidatiemiddelen. Het reageert ook sterk met lithium en stikstof.
Wanneer het wordt verwarmd in aanwezigheid van waterstof, wordt het gereduceerd tot chroomchloride (II), met de vorming van waterstofchloride.
2 CRCL3 + H2 => 2 crcl2 + 2 HCl
pH
In een waterige oplossing, en met een concentratie van 0,2 M: 2,4.
Synthese
Chrome chloride (III) hexahydraat wordt geproduceerd en reageert chroomhydroxide met zoutzuur en water.
Cr (OH)3 + 3 HCl +3 H2O => crcl3.6h2OF
Om anhydra -zout te verkrijgen, wordt de CRCL verwarmd3.6h2Of in aanwezigheid van Tionilo -chloride, SOCL2, zoutzuur en warmte:
[Cr (H2OF)6] Cl3 + 6SOCL2 + ∆ → Crcl3 + 12 HCl + 6SO2
Als alternatief, de CRCL3 Chloorgas wordt verkregen op een mengsel van chroom en koolstofoxide.
Cr2OF3 + 3 C +Cl2 => 2 crcl3 + 3 CO
En ten slotte, als de meest gebruikte methode, is het om zijn oxide te verwarmen met een halogenantmiddel, zoals koolstoftetrachloride:
Cr2OF3 + 3CCL4 + ∆ → 2Clcl3 + 3COCL2
Toepassingen
Industriëlen
Chrome chloride komt tussenbeide in de op -site bereiding van chroomchloride (II); Reagens dat tussenbeide komt bij de reductie van alkylhalogeniden, en in de synthese van haluros van (E) -Salquenilo.
Kan u van dienst zijn: natriumoxalaat (NA2C2O4): structuur, eigenschappen, gebruik, risico's-Het wordt gebruikt in de verchroomde techniek. Dit bestaat uit het afzetten van, door galvanoplastiek, een fijne laag chroom op metalen objecten of ander materiaal met een decoratief doel, waardoor de corrosieweerstand wordt verhoogd en ook de oppervlaktehardheid.
-Het wordt gebruikt als een textiel bijtonen, die dient als een link tussen het kleurmateriaal en de te versterken stoffen. Bovendien wordt het gebruikt als katalysator voor de productie van olefines en waterdichte middelen.
Therapeutica
Het gebruik van UP Chrome -chloridesupplement wordt aanbevolen bij patiënten die alleen intraveneuze oplossingen ontvangen, toegediend voor totale parenterale voeding (TPN). Daarom, alleen wanneer deze patiënten niet al hun voedingsvereisten ontvangen.
Chroom (III) maakt deel uit van de glucosetolerantiefactor, een activator van de reacties bevorderd door insuline. Er wordt gedacht dat chroom (III) het metabolisme van glucose, eiwitten en lipiden activeert, waardoor de werking van insuline bij mensen en dieren wordt vergemakkelijkt.
Chroom is aanwezig in talloze voedingsmiddelen. Maar de concentratie is niet groter dan 2 door rantsoen, de broccoli is het voedsel met de grootste bijdrage (11 µg). Bovendien is de darmabsorptie van chroom laag, met een waarde van 0,4 tot 2,5% van de ingenomen hoeveelheid.
Dit maakt het moeilijk om een dieet te vestigen voor Chrome Supply. In 1989 heeft de National Academy of Sciences tussen 50 en 200 µg/dag aanbevolen als een adequate Chrome -inname.
Risico's
Een van de mogelijke risico's van de consumptie van dit zout als chroomsupplement zijn:
-Sterke buikpijn.
-Abnormale bloedingen, die kunnen variëren van moeilijkheden om een wond, rode verste kneuzingen of verduistering van het fecale ontlastingproduct van interne bloedingen te genezen.
-Irritaties in het spijsverteringssysteem, waardoor maagzweren of darmen worden veroorzaakt.
-Dermatitis
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Chroom (III) chloride. Opgehaald uit: in.Wikipedia.borg
- Chroom (III) chloride [PDF]. Hersteld van: alpha.Chem.Uil.Edu
- Pubchem. (2019). Chroomchloride hexahydraat. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- National Institute of Health. (21 september 2018). Chroom: Factblad Dieet supplement. Opgehaald uit: SDG.OD.NIH.Gov
- Tomlinson Carole a. (2019). Bijwerkingen van chroomchloride. Leaf Group Ltd. Hersteld van: gezond.com
- « Waarom is het belangrijk om te lezen? 10 voordelen van lezen
- Borax geschiedenis, structuur, eigenschappen, gebruik, synthese, risico's »

