Borax geschiedenis, structuur, eigenschappen, gebruik, synthese, risico's

- 2676
- 668
- Aaron Okuneva
Hij Borax of natriumboraat Het is een denominatie voor een groep chemische verbindingen met een basisformule van NA2B4OF7. Het is een hygroscopisch zout dat in staat is talloze hydraten te vormen, naast het structureel verrijken door de aanwezigheid van bepaalde metaalonzuiverheden.
De belangrijkste verbindingen die Borax worden genoemd, zijn de volgende: Anhydro Natrium Tetraborate, NA2B4OF7; Pentahydraat natriumtetraboraat (NA2B4OF7)).5h2OF; en natriumtetraboraat, na2B4OF7.10h2Of, of het equivalent ervan, het octahydraat natriumtetraboraat, na2B4OF5(OH)4.8h2OF.
 Borax -fragment. Bron: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Borax -fragment. Bron: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Zoals te zien is, verschillen alle eerdere vaste stoffen alleen in hun mate van hydratatie; Sommigen hebben meer watermoleculen in hun kristallen dan andere. Fysiek Borax is vergelijkbaar met stukken of robuuste krijtkristallen (superieure afbeelding).
Natuurlijk wordt borax gevonden in sedimenten van seizoensgebonden meren, gedroogd door verdamping. Borax komt voor in Turkije, Searles Lakes (Californië), in de Atacama, Chili, Bolivia, Tibet en Roemenië woestijn. Synthetisch kunnen boraxkristallen worden verkregen via een langzaam nucleatieproces; dat wil zeggen, een waarin de groei van de kristallen wordt begunstigd.
Het natrium, watervrij en vervallen tetraboraat zijn weinig oplosbaar in koud water; Maar de oplosbaarheid ervan neemt toe met een toename van de temperatuur. Dan een2B4OF7.10h2Of het is erg oplosbaar in ethyleenglycol, matig oplosbaar in ethanol en weinig oplosbaar in aceton; Dit zijn minder polaire oplosmiddelen dan water.
Borax heeft talloze toepassingen, zoals bij de uitwerking van wasmiddelen en zeeps; als een vertraging van het vuur van het cellulosemateriaal; in de productie van glasvezel; bij het reinigen van harde oppervlakken zoals metalen, glas en keramiek; en bij corrosieremming, onder andere toepassingen.
Borax is irritant voor ogen, huid en luchtwegen. Door inname kan het, onder andere symptomen, braken, diarree, doorzakken, verval en aanvallen produceren. Momenteel wordt vermoed dat schadelijke effecten op de menselijke reproductie kunnen hebben.
[TOC]
Geschiedenis
De geschiedenis van Borax is verwarrend. Er wordt op gewezen dat het werd ontdekt in het bed van een Tibet -meer, gedroogd door verdamping. Het werd overgebracht in de zevende eeuw van Tibet naar de Saoedi -Arabië, na de zo -aangedreven zijderoute.
De term "Borax" was populair volgens de vele toepassingen die werden gevonden en op de markt gebracht onder de naam van 20 Mule Team Borax Tradeermax, die verwees naar de manier waarop de Borax werd getransporteerd door de woestijnen van Nevada en Californië.
Een andere versie van hun ontdekking geeft aan dat de Egyptenaren al lange tijd om hun bestaan hebben geweten, het in de lassen van metalen door warmte gebruikt. Bovendien gebruikten ze het in de geneeskunde en in het mummificatieproces. Borax werd in de dertiende eeuw naar Europa overgebracht door Marco Polo.
In het midden van de nineteenth eeuw werden grote boraxafzettingen ontdekt in de Magove -woestijn, die het gebruik ervan sindsdien gebruikelijk maakte.
Borax -structuur
 Borax -ionstructuur. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Borax -ionstructuur. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Het superieure beeld toont de ionen die de borax vormen, specifiek overeenkomend met een vaste stof met een compositorische formule van NA2[B4OF5(OH)4] · 8h2Of (of na2B4OF7· 10h2OF).
Ten eerste kan de gekooide structuur van het anion worden opgemerkt [B4OF5(OH)4]2- (Hoewel ik twee groepen zou moeten hebben-), waarin een achthoekige ring (vier atomen van B en vier van O) te zien is), met een B-O-B-brug die het in twee helften verdeelt.
Kan u van dienst zijn: alkalische oplossingen: definitie, eigenschappen en gebruikDeze kooi blijft niet statisch, maar trilt en neemt verschillende conformaties in de ruimte aan; In mindere mate echter in de buurt van de brug. Het kan ook worden opgemerkt dat het erg "geoxygeneerd" is; Dat wil zeggen, het heeft veel zuurstofatomen, in staat om te interageren met watermoleculen met behulp van waterstofbruggen.
Het is dan niet verwonderlijk dat Borax -kristallen kunnen hydrateren en talloze hydraten kunnen genereren. Dus voor de vaste NA2[B4OF5(OH)4] · 8h2Of er zijn acht H -moleculen2Of interactie met de boraraatkooi, en tegelijkertijd, met de metalen centra van NA+.
Aan de kationzijde heb je het waterige complex [na (h2OF)4]+N, waarbij de waarde van N afhangt van het anion/kation -aandeel. In de bovenste vaste stof, n = 2, dus je hebt: [na2(H2OF)8]2+, waarvan de belasting 2+ de belasting van het boraraatanion neutraliseert.
Kristallen
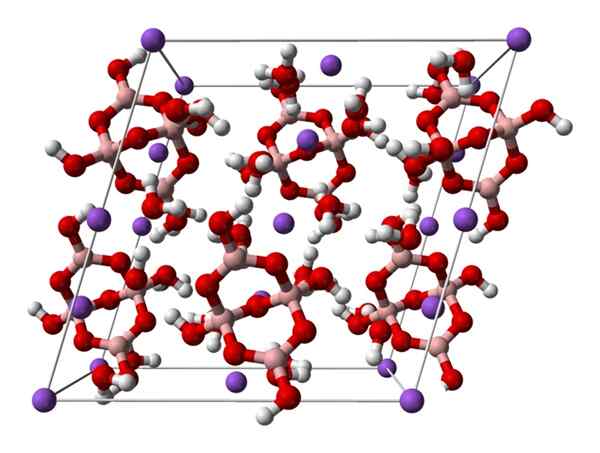 Borax monokline cel. Bron: Ben Mills [publiek
Borax monokline cel. Bron: Ben Mills [publiekDomein].
Omhoog2[B4OF5(OH)4] · 8h2Of of na2B4OF7· 10h2OF. Hier regeren of domineren elektrostatische attracties en waterstofbruggen de structurele patronen die in elk glas van het glas zijn ontstaan of domineren.
Andere hydraten en watervrijzout verliezen een of al hun watermoleculen, waardoor de samenstelling en structuur van het boraxkristal verandert. In allemaal blijven anion en kation hetzelfde (tenzij er onzuiverheden of laterale reacties zijn), dus verwarring kan niet worden gegenereerd.
Verwarring met het boraato -anion
NA2[B4OF5(OH)4] · 8h2Of en na2B4OF7· 10h2Of ze zijn hetzelfde. Omdat?
Ten eerste, als hun atomen worden geteld, zullen ze zien dat ze samenvallen in aantal; En ten tweede, in Anion B4OF72- De afwezigheid van de twee OH-groepen die verband houden met de boorkoppen van de B-O-B-bruggen wordt overwogen; twee oh dat, samen met de twee h+ van B4OF72-, Voeg maximaal 2 H op2Of, in totaal 10 uur2O (8 + 2).
Eigenschappen
Namen
- Borax.
- Natriumboraraat.
- Natriumtetraboraat.
- Doorbaar tetraboraat.
Moleculaire massa
Anhydro: 201,22 g/mol.
Decohydraat: 381.38 g/mol.
Fysiek uiterlijk
Een kristallijne witte vaste stof.
Dikte
Watervrij: 2,4 g/cm3
Decahixture: 1.739 g/cm3
Smeltpunt
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decohydraat: 75 ºC.
Kookpunt
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
Oplosbaarheid in water
31,78 g/l (zowel voor watervrij als decayroper).
Oplosbaarheid in biologische oplosmiddelen
Het is erg oplosbaar in ethyleenglycol, matig oplosbaar in diethyleenglycol en methanol, en enigszins oplosbaar in aceton.
Brekingsindex (ηd)
Anhidro: η1 = 1.447; η2 = 1.469.
Decayedrado: η2 = 1,472.
Stabiliteit
Het is stabiel onder voldoende opslagomstandigheden. Hoewel het een lage stoomdruk heeft, neemt het toe met de temperatuur, waardoor kristallisatie en condensatie veroorzaakt, dus overmatige temperatuur en vochtschommelingen moeten worden vermeden.
Lichtemissie
Het natriumtetraboraat wanneer onderworpen aan de werking van vuur straalt een groen licht uit.
Reacties
- Bij het oplossen in het water zijn alkalische oplossingen afkomstig van een pH rond 9.2.
- Borax reageert op andere boraten, zoals perborate (PBS).
- Het produceert ook boorzuur bij het reageren met zoutzuur:
NA2B4OF7· 10h2O + HCl => 4 H3Bo3 + 2 NA+ + 2 Cl- + 5 H2OF
- Het natriumtetraboraat gedraagt zich als een amfohete -substantie, omdat het in waterige oplossing wordt gehydrolyseerd en zuur kan neutraliseren. Op dezelfde manier is het in staat om alkalis met hoge concentratie te neutraliseren, waardoor overmatige verhoging van de medium pH wordt vermeden.
Kan u van dienst zijn: primaire alcohol: structuur, eigenschappen, nomenclatuur, voorbeeldenToepassingen
Borax heeft talloze toepassingen, zowel in de mens als in de reeks activiteiten die het uitvoert.
Antioxiderende actie
Borax heeft de mogelijkheid om oxiden op te lossen. Om deze reden wordt het gebruikt bij het herstel van metalen zoals messing, koper, lood en zink.
Het wordt ook gebruikt om oxidatie van metaalstaven in de funderingen te voorkomen. Borax bedekt zijn oppervlak, exclusief de lucht en daarom oxidatie vermijden. Bovendien voorkomt het corrosie van ferro -materiaal bij de productie van auto's.
Borax -oplosbaarheid in ethyleenglycol is nuttig geweest in antivriesformuleringen. Borax neutraliseert het zure afval dat wordt geproduceerd tijdens de ontleding van ethyleenglycol, waardoor de oxidatie wordt geminimaliseerd die het oppervlak van metalen kan lijden.
Uitwerking van lijmen
- Borax maakt deel uit van een zelfklevende zetmeelformulering voor golfplant en karton.
- Het is een peptisatiemiddel bij de productie van lijmen op basis van caseïne en dextrin.
- Handelt het versterken van de lijmmaterialen door de geconjugeerde hydroxillengroepen over te steken.
Brandweer
Het wordt gebruikt als brandvertragend in cellulosematerialen en andere polymeren die hydroxilli -groepen bevatten. Het oefent zijn werking uit door verschillende mechanismen, waaronder de vorming van een glasachtige laag die de toegang van brandstoffen beperkt.
Borosiliseerde glazen uitwerking (pyrex)
Borax is een bron van boor die wordt gebruikt bij de uitwerking van geborosiliseerd glas; Gekenmerkt door een hoog fusiepunt, lage expansiecoëfficiënt en hoge weerstand tegen thermische schokken.
Hierdoor kunt u onderworpen zijn aan hoge temperaturen zonder breuken te ervaren, waarbij u de vuurvaste glazen denominatie krijgt.
Geborosiliseerd glas wordt gebruikt bij de uitwerking van materialen die thuis worden gebruikt om voedsel te bakken. Het wordt ook gebruikt in het laboratorium in beker, fixolas, meet cilinders, pipetten, enz.
Emulgator
Borax wordt samen met andere verbindingen gebruikt om zepen en andere paraffines te emulgeren. Het wordt ook gebruikt als basis voor de uitwerking van lotions, crèmes en zalven.
Schoonmaakmateriaal
- Het wordt in de formuleringen toegevoegd om vaste oppervlakken zoals metalen, glas en keramiek schoon te maken.
- Het wordt gebruikt in handreinigers, polijstmateriaal en wasmiddel zepen van gebruik in wasseries en thuis. Bovendien vergemakkelijkt het de verwijdering van olieachtige afzettingen uit de vloeren van de fabrieken.
Medisch gebruik
- Het wordt gebruikt bij de behandeling van voetschimmelsinfecties.
- Het maakt deel uit van de voedingsformule die boor levert. Men denkt dat dit element tussenbeide komt in calcium-, fosfor- en magnesiummetabolisme, noodzakelijk voor de botstructuur.
- Het grijpt in bij de bepaling van geglycosyleerd hemoglobine (HbA1c), het bewijs dat dient om de ontwikkeling van diabetes op lange termijn bij een patiënt te kennen, omdat de halfwaardetijd van een erytrocyt 120 dagen is.
Deze informatie is nuttiger voor de arts dan geïsoleerde bepalingen van de bloedglucose van de patiënt.
PH -schokdemper
Het wordt gebruikt in verschillende pH -schokdempers die in biochemie worden gebruikt; Onder hen, de tris (hydroxymethyl) aminomethaan-boorstaat, gebruikt in elektroforese in polyacrylamide van DNA- en RNA-nucleïnezuren.
Afname van waterhardheid
Borax is in staat om te combineren met calcium- en magnesiumionen die in het water aanwezig zijn, waardoor de concentratie afneemt. Op deze manier wordt de hardheid van water verminderd.
Kan u van dienst zijn: kaliumhydroxide: structuur, eigenschappen, gebruikKunstmest en kunstmest
Borax wordt gebruikt als een bron van boor. Calcium en boor zijn betrokken bij de vorming van de celwand van de planten. Bovendien is erop gewezen dat boor de bestuiving bevordert, zodat het tussenbeide komt in de bemesting en proliferatie van planten.
Houten behoud
Borax vecht tegen het bos, een kever die het hout consumeert en vernietigt. Het wordt ook gebruikt bij het behoud en onderhoud van houten schepen.
Oprichting en stroming
Het wordt gebruikt als oprichter in staal en ijzerlassen, wat een afname van het smeltpunt en de eliminatie van ijzeroxide veroorzaakt; Een ongewenste verontreinigende stof. Met een soortgelijk einde neemt het deel aan het lassen van goud en zilver.
Anderen
- Het wordt gebruikt als een zacht pesticide; Bijvoorbeeld voor het gevecht van motten in wol.
- Gespoten dient voor de controle van ongedierte aanwezig in kasten, interne afzettingen, in de openingen van de muren en in het algemeen, waar het gebruik van meer vervuilende pesticiden niet gewenst is.
- Het wordt gebruikt in kernreactoren om reacties te controleren die in extreme gevallen een kettingreactie kunnen produceren.
- In auto's radiatoren wordt Borax gebruikt om de locaties te krijgen waar water ontsnapt.
Synthese
Borax wordt verkregen door React5OF9.8h2Of, met natriumcarbonaat en natriumkoolwaterbonaat in waterig medium.
Eigenlijk wordt de synthese van natrium- of borax -tetraboraat weinig gebruikt; De meeste geproduceerde verbinding wordt verkregen door de extractie van de mineralen die het bevatten.
Het proces kan worden samengevat in een oplossing van het erts in water, gevolgd door een kleipiltratie en uiteindelijk een verdamping van de waterige oplossing.
Risico's
Borax is een natuurlijk product, maar het kan een reeks gezondheidsschade bij mensen veroorzaken. Bijvoorbeeld, vanwege contact met het stofstof, kan een irritatie van de huid die dermatitis kan veroorzaken optreden.
Evenzo produceert Borax irritatie van de ogen en de bovenste luchtwegen. Onder de symptomen van de inademing ervan zijn er hoest- en keelpijn.
Ondertussen presenteert Borax Intake de volgende symptomen: braken, misselijkheid, diarree, doorzakken, hoofdpijn en aanvallen. Bovendien kan een affectie van het centrale zenuwstelsel en het nierfunctioneren optreden.
Uit studies uitgevoerd bij mannelijke ratten, gevoed met borax, werd testiculaire atrofie waargenomen. Terwijl studies uitgevoerd met zwangere vrouwelijke ratten erop wezen dat Borax de placenta kon oversteken, waardoor een wijziging van de foetale ontwikkeling kon produceren, gemanifesteerd door een laag geboortegewicht.
Er wordt aangenomen dat blootstelling aan borax de mannelijke reproductieve functie bij de mens kan beïnvloeden, gemanifesteerd door een vermindering van het aantal sperma.
Een fatale dosis van 10 tot 25 gram wordt geschat voor borax -inname bij volwassenen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Nationaal centrum voor biotechnologie -informatie. (2019). Argon. PubChem -database. CID = 23968. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Karolyn Burns, Seneca Joseph, & Dr. Ryan Baumbach. (S.F.)). Synthese en eigenschappen van boraxkristallen en intermetalllische legeringen. Hersteld van: nationalMaglab.borg
- Wikipedia. (2019). Borax. Opgehaald uit: in.Wikipedia.borg
- Rio Tinto. (2019). Borax uitdrogen. 20 Mule Team Borax. Hersteld van: Borax.com
- Fletcher Jenna. (14 januari 2019). Is Borax veilig om te gebruiken? Hersteld van: MedicalNewstody.com
- « Chrome chloride (Crcl3) structuur, eigenschappen, gebruik
- Transgene voedselkenmerken, voordelen, voorbeelden, gevolgen »

