Koperchloride (i) (CUCL) structuur, eigenschappen, gebruik
- 4011
- 259
- James Dach
Hij koperchloride (i) Het is een anorganische verbinding gevormd door koper (Cu) en chloor (CL). De chemische formule is CUCL. Het koper in deze verbinding heeft Valencia van +1 en de chloor -1. Het is een witte kristallijne vaste stof die bij blootstelling van een lange tijd in de lucht een groenachtige kleuring verwerft vanwege de oxidatie van koper (I) tot koper (ii).
Het gedraagt zich als Lewis -zuur dat elektronen van andere verbindingen nodig heeft die Lewis -basen zijn, waarmee complexe of stabiele adducten vormen. Een van deze verbindingen is koolmonoxide (CO), dus het vermogen om tussen hen mee te doen, wordt industrieel gebruikt om de CO van frisdranken te extraheren.
 Koperchloride (I) (CUCL) gezuiverd. Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Koperchloride (I) (CUCL) gezuiverd. Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Het heeft optische eigenschappen die kunnen worden gebruikt in licht die halfgeleiders emitteert. Bovendien hebben CUCL -nanocubes een groot potentieel om te worden gebruikt in efficiënte energieapparaten.
Het wordt gebruikt in de kunst van pyrotechniek omdat in contact met een vlam een blauwachtig groen licht produceert.
[TOC]
Structuur
De CUCL wordt gevormd door het Cuproso Cup -ion+ en anionchloride cl-. De elektronische configuratie van de ionen cu+ is:
1s2 2s2 2 p6 3S2 3P6 3D10 4S0
En het is omdat koper het elektron van de 4s -laag verloor. Het chloride -ion heeft de configuratie:
1s2 2s2 2 p6 3S2 3P6
Het is te zien dat beide ionen hun complete elektronische lagen hebben.
Deze verbinding kristalliseert met kubieke symmetrie. In de onderstaande afbeelding wordt de opstelling van de atomen in een kristallijne eenheid waargenomen. Roze bollen komen overeen met koperen en groene bollen met chloor.
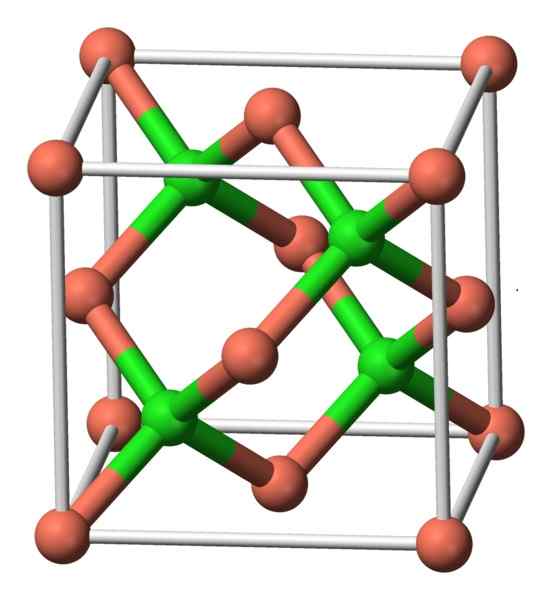 CUCL -structuur. Auteur: Benjah-BMM27. Bron: Wikimedia Commons.
CUCL -structuur. Auteur: Benjah-BMM27. Bron: Wikimedia Commons. Nomenclatuur
- Koperchloride (i)
- Koperchloride
- Koperen monokloride
Eigenschappen
Fysieke staat
Kristallijne witte vaste stof die in langdurige lucht met lucht wordt geoxideerd en groen wordt.
Molecuulgewicht
98,99 g/mol
Smeltpunt
430 ºC
Kookpunt
Ongeveer 1400 ºC.
Dikte
4.137 g/cm3
Oplosbaarheid
Bijna onoplosbaar in water: 0,0047 g/100 g water bij 20 ° C. Onoplosbaar in ethanol (c2H5Oh) en aceton (kies3(C = o) ch3)).
Het kan u van dienst zijn: Alilo: Allyic Unit, carbocatie, radicaal, voorbeeldenChemische eigenschappen
Het is onstabiel in de lucht omdat Cu+ heeft de neiging om Cu te oxideren2+. In de loop van de tijd wordt kupricoxide (CuO), koperhydroxide (CuOH) of een complex oxychloride en zout groen.
 Koperchloride (I) die is blootgesteld aan de omgeving en gedeeltelijk geoxideerd. Cuoh, Cuoh en andere verbindingen kunnen bevatten. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons.
Koperchloride (I) die is blootgesteld aan de omgeving en gedeeltelijk geoxideerd. Cuoh, Cuoh en andere verbindingen kunnen bevatten. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons. In waterige oplossing is het ook onstabiel omdat een oxidatie- en reductiereactie tegelijkertijd optreedt, waardoor metallic koper en koperion (II) wordt gevormd:
CUCL → Cu0 + CUCL2
De CUCL als Lewis Acid
Deze verbinding fungeert chemisch als Lewis -zuur, wat betekent dat het enthousiast is voor elektronen, zodat het stabiele adducten vormt met verbindingen die ze kunnen bieden.
Het is erg oplosbaar in zoutzuur (HCL), waar clionen- Ze gedragen zich als elektronendonoren en soorten zoals CUCL worden gevormd2-, CUCL32- En Cu2Klet42-, onder andere.
 Dit is een van de soorten die worden gevormd in de CUCL -oplossingen in HCL. Auteur: Marilú Stea.
Dit is een van de soorten die worden gevormd in de CUCL -oplossingen in HCL. Auteur: Marilú Stea. Waterige CUCL -oplossingen hebben het vermogen om koolmonoxide te absorberen (CO). Deze absorptie kan optreden wanneer deze oplossingen zowel zuur als neutraal of met ammoniak zijn (NH3)).
In dergelijke oplossingen wordt geschat dat verschillende soorten zoals Cu (CO) worden gevormd+, Koekoek)3+, Koekoek)4+, CUCL (CO) en [Cu (CO) CL2]-, die afhangt van het medium.
Andere eigenschappen
Het heeft elektroopente kenmerken, laag optisch verlies in een breed bereik van het lichtspectrum van zichtbaar tot infrarood, lage brekingsindex en constant diëlektrisch laag.
Het verkrijgen van
Koperchloride (I) kan worden verkregen door het metalen koper rechtstreeks met chloorgas te reageren bij een temperatuur van 450-900 ° C. Deze reactie is industrieel van toepassing.
2 Cu + Cl2 → 2 CUCL
U kunt ook een reducerende verbinding gebruiken, zoals ascorbinezuur of zwaveldioxide om koperchloride (II) door te geven aan koperchloride (I). Bijvoorbeeld in het geval van de SO2, Dit wordt geoxideerd tot zwavelzuur.
2 CUCL2 + SW2 + 2 H2O → 2 CUCL + H2SW4 + 2 HCl
Toepassingen
In co -herstelprocessen
Het vermogen van de absorberende en insorberoplossingen.
Kan u van dienst zijn: turbidimetrieHet proces dat CosorB wordt genoemd, gebruikt bijvoorbeeld gestabiliseerd koperchloride in de vorm van een complex zout met aluminium (Anycl4), die oplost in een aromatisch oplosmiddel zoals tolueen.
De oplossing absorbeert de CO van een gasvormige stroom om deze te scheiden van andere gassen zoals CO2, N2 en ch4. Dan wordt de oplossing die rijk is aan het monoxide onder verminderde druk (dat wil zeggen lager dan de atmosferische) en de CO is exorg. Het op deze manier teruggewonnen gas is een hoge zuiverheid.
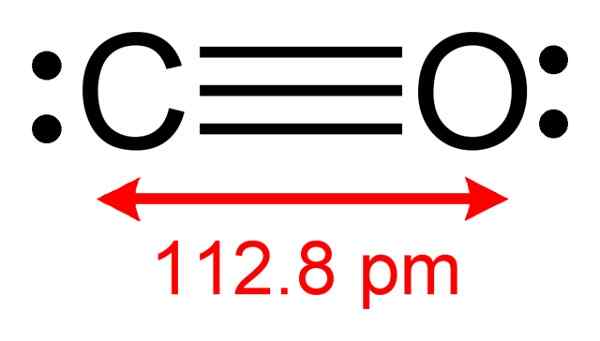 Koolmonoxidestructuur waarbij elektronen beschikbaar zijn om complex te vormen met de CUCL worden waargenomen. Auteur: Benjah-BMM27. Bron: Wikimedia Commons.
Koolmonoxidestructuur waarbij elektronen beschikbaar zijn om complex te vormen met de CUCL worden waargenomen. Auteur: Benjah-BMM27. Bron: Wikimedia Commons. Met dit proces kunt u een pure CO verkrijgen.
Bij katalyse
De CUCL wordt gebruikt als katalysator voor verschillende chemische reacties.
Bijvoorbeeld de reactie van het Germanio (GE) -element met waterstofchloride (HCl) en ethyleen (CH2= Ch2) kan worden gedaan met behulp van deze verbinding. Het dient ook voor de synthese van organische siliciumverbindingen en variërende heterocyclische organische derivaten van zwavel en stikstof.
U kunt een polyfenileenpolymeer synthetiseren met behulp van een 4-amypirine- en gehurkt katalytisch systeem. Dit polymeer is zeer nuttig voor zijn mechanische eigenschappen, weinig vochtabsorptie, uitstekende isolatie van elektriciteit en brandweerstand.
Bij het verkrijgen van organische koperen verbindingen
Alkenilcupratato -verbindingen kunnen worden bereid door een terminal alky te reageren.
Bij het verkrijgen van polymeren verenigd tot metalen
Koperchloride (I) kan worden gecoördineerd met polymeren die complexe moleculen vormen die als katalysatoren dienen en die de eenvoud van een heterogene katalysator combineren met de regelmaat van een homogene.
In halfgeleiders
Deze verbinding wordt gebruikt bij het verkrijgen van een materiaal gevormd door γ-corpu op silicium.
Deze materialen worden breed gebruikt in ultraviolet licht die diodes, laserdioden en lichtdetectoren emitteert.
Kan u dienen: kaliumbromide (kBr): structuur, eigenschappen, gebruikIn super cardpisors
Dit product verkregen in de vorm van kubieke of nanocubes nanodeeltjes maakt het mogelijk om supercaders te produceren, omdat het een uitstekende belastingssnelheid, hoge omkeerbaarheid en klein verlies van capaciteit heeft.
Supercorders zijn apparaten voor het opslaan van energie die opvallen voor hun hoge vermogensdichtheid, werking in de operatie, snelle laad- en ontladingscycli, stabiliteit op lange termijn en zijn milieuvriendelijk.
 Nanocubos CUCL kan worden gebruikt in elektronica- en energieopslagtoepassingen. Auteur: Tide hij. Bron: Pixabay.
Nanocubos CUCL kan worden gebruikt in elektronica- en energieopslagtoepassingen. Auteur: Tide hij. Bron: Pixabay. Andere apps
Geven.
 De groene kleur van sommige vuurwerk kan te wijten zijn aan de snurk. Auteur: Hans Braxmeier. Bron: Pixabay.
De groene kleur van sommige vuurwerk kan te wijten zijn aan de snurk. Auteur: Hans Braxmeier. Bron: Pixabay. Referenties
- Milek, J.T. en Neuberger, m. (1972). Chloride -koper. In: lineaire elektrooptische modulaire materialen. Springer, Boston, MA. Link hersteld.Springer.com.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Sneeden, r.P.NAAR. (1982). Absorptie/disorptie -methoden. In uitgebreide organometallische chemie. Deel 8. Hersteld van Scientedirect.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Chandrashekhar, V.C. et al. (2018). Recente ontwikkelingen in directe synthese van organometallische en coördinatieverbindingen. In directe synthese van metaalcomplexen. Hersteld van Scientedirect.com.
- Kyushin, s. (2016). Organosiliconsynthese voor de constructie van organosiliconclusters. In efficiënte methoden voor voorbereiding siliciumverbindingen. Hersteld van Scientedirect.com.
- Van Koten, G. en Noltes, J.G. (1982). Organocopperverbindingen. In uitgebreide organometallische chemie. Deel 2. Hersteld van Scientedirect.com.
- Danieluk, D. et al. (2009). Optische eigenschappen van niet -gepoteerde en zuurstof gedoteerde CUCL -films op silicium sublate. J Mater Sci: Mater Electron (2009) 20: 76-80. Link hersteld.Springer.com.
- Yin, B. et al. (2014). Cuprous chloride nanocubes gekweekt op koperfalen voor pseudocapacitator -elektroden. Nano-Micro Lett. 6, 340-346 (2014). Link hersteld.Springer.com.
- Kim, K. et al. (2018). Een zeer efficiënte aromatische amin ligand/koper (I) chlorid. Polymeren 2018, 10, 350. MDPI hersteld.com.
- Wikipedia (2020). Koper (i) chloride. Opgehaald van.Wikipedia.borg.
- « Molaire fractie hoe het wordt berekend, voorbeelden, oefeningen
- Butyric vet verkrijgen, typen, samenstelling, gebruik, voordelen »

