Natriumcitraat (C6H5O7NA3) structuur, gebruik, eigenschappen
- 4972
- 1363
- Kurt Aufderhar Jr.
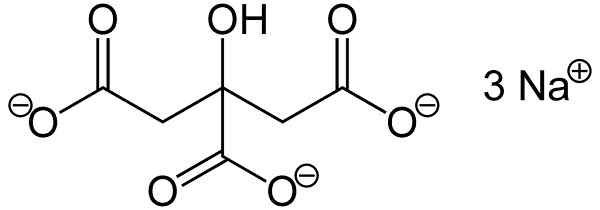
Hij natriumcitraat Het is het natriumzout van citroenzuur. Het wordt gevormd door een anioncitraat c6H5OF73- en drie natrium na kationen+. De moleculaire formule is c6H5OF7NA3 of in zijn uitgebreide vorm: NaOOC-CH2-C (agone) (oh) -ch2-Pad. Natriumcitraat is de geconjugeerde basis van citroenzuur, dat wil zeggen, de laatste wordt verkregen uit de laatste door elk proton h te vervangen+ van -cooh voor een natriumknik+.
Het kan worden bereid in anhydra (zonder water in zijn samenstelling) of in zijn gehydrateerde vorm met 2 of 5 watermoleculen. Het is een verbinding dat wanneer watervrij (zonder water) de neiging heeft om water uit de omgeving te absorberen.
 Trisodium citraatmolecuul. Auteur: Marilú Stea.
Trisodium citraatmolecuul. Auteur: Marilú Stea. Natriumcitraat werkt als een buffer, dit betekent dat pH stabiliseert, wat een maat is voor de zuurgraad of basiciteit van een waterige oplossing. Het heeft ook de eigenschap om een stabiele verbinding te vormen met CA Calcium -ionen2+, Calciumcitraat.
Het wordt bijvoorbeeld gebruikt in de voedingsindustrie om te voorkomen dat koeienmelkvormen klontjes moeilijk te verteren zijn door zuigelingen.
In bioanalyslaboratoria wordt het gebruikt om het bloed te voorkomen dat patiënten worden geëxtraheerd voor bepaalde tests. Het voorkomt ook dat het het bloed dat wordt gebruikt in transfusies niet bedekt. Het wordt veel gebruikt in fosfaatvrije wasmiddelen omdat het niet vervuilend is.
[TOC]
Structuur
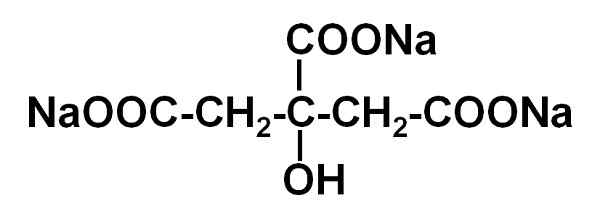
Trisodio citraat bestaat uit drie natrium na ionen+ en een citraation.
Het citraation bestaat uit een keten van drie koolstofatomen waarmee 3 carboxyaten verenigd zijn- (één voor elk koolstofatoom) en een hydroxyl -OH in de centrale koolstof.
Elk van de 3 NA -ionen+ is gekoppeld aan een groep -coo-.
 Trisodium citraatstructuur. Jü [Public Domain]. Bron: Wikimedia Commons.
Trisodium citraatstructuur. Jü [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
- Natriumcitraat
- Trisodio citraat
- 2-hydroxipropaan-1,2,3-tricarboxylaat trisodium
Eigenschappen
Fysieke staat
Wit of kleurloze kristallijne vaste stof.
Molecuulgewicht
258.07 g/mol
Smeltpunt
300 ºC
Oplosbaarheid
Het is erg oplosbaar in water: 42,5 g/100 ml bij 25 ºC. Het is praktisch onoplosbaar in alcohol.
pH
Een waterige oplossing voor 5% natriumcitraat heeft een pH tussen 7,5 en 9,0, dat wil zeggen, het is enigszins alkalisch.
Chemische eigenschappen
Natriumcitraat is een buffer, wat betekent dat de pH stabiliseert, wat een maat is voor de zuurgraad of alkaliteit van een waterige oplossing. Citraat bij het stabiliseren van de pH stelt de oplossing niet toe aan verzuiverd of alkaliseerd boven bepaalde waarden.
Kan u van dienst zijn: Kernel Elektronische configuratie: constructie, voorbeeldenAls er overtollige protonen zijn h+ Ik neem ze mee om hun groepen te converteren -coo- In groepen -coh. Vice versa, als er veel OH -groepen zijn- levert de protonen van hun groepen -coh en maakt ze -coo-.
Wanneer het wordt getransformeerd door het lichaam, biedt het 3 HCO -moleculen3- Voor elk citraatmolecuul.
Andere eigenschappen
Zijn kristallen zijn heerlijk, dat wil zeggen, ze absorberen lucht uit de lucht. Dihydrated natriumcitraat is stabieler in de lucht.
Als het dihydraat wordt verwarmd, wanneer het 150 ºC bereikt, wordt het watervrij (zonder water).
Net als citroenzuur heeft natriumcitraat een zure smaak.
Het verkrijgen van
Natriumcitraat wordt meestal verkregen door natriumcarbonaat toe te voegen aan een citroenzuuroplossing totdat de bruisende beurzen ophouden. Efervescence is te wijten aan het detacheren van koolstofdioxide2:
NA2CO3 + Citroenzuur → natriumcitraat + co2↑
Dan verdampt het water van de oplossing om het product te kristalliseren.
Het kan ook worden bereid door een natriumsulfaatoplossing te behandelen met calciumcitraat:
NA2SW4 + Calciumcitraat → natriumcitraat + case4↓
De oplossing wordt gefilterd om de behuizing te verwijderen4 Vaste stof die is neergeslagen. Dan is de oplossing geconcentreerd en kristalliseert dus natriumcitraat.
Locatie in de natuur
Natriumcitraat is de geconjugeerde basis van citroenzuur, een natuurlijke verbinding die in alle levende organismen wordt gevonden omdat het deel uitmaakt van zijn metabolisme, het mechanisme om energie in cellen te ontwikkelen.
Toepassingen
In de voedingsindustrie
Natriumcitraat heeft verschillende toepassingen in de voedingsindustrie, bijvoorbeeld als regulator van zuurgraad, ontvoering, stabilisator, oppervlakteactieve agent of emulgator.
Het wordt onder andere gebruikt in drankjes, bevroren desserts en speciale kazen, onder andere producten.
Het maakt het mogelijk om de coagulatie van de melk te voorkomen, dus wordt het toegevoegd aan de koemelk die wordt gebruikt voor het voeden van zuigelingen. Op deze manier worden geen colleges of harde -tot -digest krullen gecreëerd door de maag van de kleintjes.
 U kunt natriumcitraat aan melk toevoegen, zodat knobbels niet in de maag worden gevormd. Auteur: Couleur. Bron: Pixabay.
U kunt natriumcitraat aan melk toevoegen, zodat knobbels niet in de maag worden gevormd. Auteur: Couleur. Bron: Pixabay. Het wordt gebruikt om kleurbevestiging in varkensvlees of gezouten vaccins te versnellen, dat wil zeggen behandeld vlees om de ontleding te voorkomen. Tot 50% ascorbinezuur wordt hierin vervangen.
Kan u van dienst zijn: siliciumzuur Varkens uitgehard vlees dat waarschijnlijk natriumcitraat bevat. Auteur: Ben Kerckx. Bron: Pixabay.
Varkens uitgehard vlees dat waarschijnlijk natriumcitraat bevat. Auteur: Ben Kerckx. Bron: Pixabay. Het dient ook om bloedstolling in vers vaccinevlees te voorkomen (zoals steaks).
In de geneeskunde
Het wordt gebruikt als een alkalisatiemiddel, omdat het overtollig zuur in bloed en urine neutraliseert. Het is aangegeven om metabole acidose te behandelen die optreedt wanneer het lichaam te veel zuur produceert.
Zodra het citraation is ingenomen, wordt het een bicarbonaat -ion dat een systemisch alkalisatiemiddel is (dat wil zeggen het hele lichaam) en bijgevolg neutraliseren de ionen h neutraliseer+, Verhoogt de pH van het bloed en keert de acidose terug of elimineert.
Natriumcitraat dient als een neutraliserend middel voor maag ongemak.
Het wordt gebruikt als slijmoplossend en zweet. Het heeft diuretische actie. Verhoog de calciumuitscheiding van de urine, die wordt gebruikt bij hypercalciëmie, dat is wanneer er een overmaat calcium in het bloed is.
Het dient ook om de eliminatie van lood te vergemakkelijken wanneer vergiftiging met dit metaal plaatsvindt.
Als overtollig wordt toegediend, kunnen alkalose worden geproduceerd, spierspasmen verschuldigd.
Natriumcitraat wordt gebruikt bij transfusies. Het wordt samen met dextrose aan het bloed toegevoegd om de coagulatie te voorkomen.
 Opgeslagen bloed voor transfusies. Bevat waarschijnlijk natriumcitraat. Auteur: Kshirl02. Bron: Pixabay.
Opgeslagen bloed voor transfusies. Bevat waarschijnlijk natriumcitraat. Auteur: Kshirl02. Bron: Pixabay. Normaal gesproken metaboliseert de lever snel het citraat verkregen in de transfusie, maar tijdens transfusies van grote hoeveelheden kan de levercapaciteit worden overschreden.
In dergelijke gevallen omdat citraat een complex vormt met calcium, is dit een afname van het CA -calciumion2+ in het bloed. Dit kan stun, trillingen, tintelen, etc. genereren. Daarom moeten transfusies langzaam worden uitgevoerd.
In de farmaceutische industrie
Onder vele andere toepassingen wordt gebruikt om het donkerder van medicijnen te voorkomen waarin er ijzer en tannines zijn.
In bloedanalyse
Het wordt gebruikt als een anticoagulans in bloedverzameling of wanneer het moet worden opgeslagen, omdat het fungeert als een calcium -ionkist CA2+, dat wil zeggen, het bindt aan calciumionen die calciumcitraat vormen die niet is ioniseerd.
Kan u van dienst zijn: Ionische link: kenmerken, hoe het is gevormd en voorbeeldenHet wordt gebruikt in coagulatietests en bij het bepalen van de sedimentatiesnelheid van rode bloedcellen.
 Bloed Test. Auteur: Bokskopet. Bron: Pixabay.
Bloed Test. Auteur: Bokskopet. Bron: Pixabay. Het wordt gebruikt als een anticoagulans tijdens plasmaferese, procedure om te extraheren uit bloedoverteverschillende stoffen die schadelijk zijn voor het lichaam.
Bij synthese van nanodeeltjes
Het wordt gebruikt als stabilisator in de synthese van gouden nanodeeltjes. Trisodio citraat dihydrated to chloroahic acid wordt toegevoegd, waardoor een rode wijn suspensie wordt gevormd.
Natriumcitraat dient als een reductiemiddel en als een anti -region middel, omdat het wordt geadsorbeerd op nanodeeltjes.
Vanwege de negatieve citraatbelasting stoten de deeltjes de ene af met elkaar die een stabiele dispersie vermijden en vormen. Hoe hoger de kleinste citraatconcentratie is de deeltjes.
Deze nanodeeltjes dienen om medische biosensoren voor te bereiden.
In milieuvriendelijke wasmiddelen
Natriumcitraat wordt veel gebruikt in fosfaatvrije vloeibare wasmiddelen. Dit komt omdat het milieugedrag onschadelijk is omdat het een metaboliet is gevonden in alle levende organismen.
Het is gemakkelijk biologisch afbreekbaar en zwak giftig voor het waterleven. Om deze reden wordt geacht dat het een schoonmaakmiddel is met ecologisch gunstige kenmerken.
Bij het verbeteren van de exploitatie van bitumineus zand
Bitumineuze zand zijn zandige formaties die rijk zijn aan bitumen of teer, een materiaal vergelijkbaar met olie.
Natriumcitraat is met succes getest samen met NaOH -natriumhydroxide om olie uit bitumineus zand te extraheren.
Er wordt gedacht dat wanneer de citraat met de zandsteen, de ionen -coo- van citraat vormen een groot aantal negatieve belastingen op silicaruimdeeltjes. Dit produceert een betere scheiding van het zand van het bitumen door de eenvoudige afstoting van de negatieve belastingen van het grind van de negatieve belastingen van het bitumen.
In andere toepassingen
Het wordt gebruikt in fotografie, om sporenmetalen te verwijderen, in elektrodepositie en om dit te verwijderen2 van resterende gassen.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Natriumcitraat. Hersteld van: pubchem.NCBI.NLM.NIH.Gov.
- McNamara, c. (2017). Verzameling en behandeling van bloed. In Dacie en Lewis Practical Hematology (Twelfth Edition). Hersteld van Scientedirect.com.
- Steber, J. (2007). De ecotoxiciteit van het reinigen van productingrediënten. In handboek voor het reinigen/ontsmetten van oppervlakken. Hersteld van Scientedirect.com.
- Xiang, B. et al. (2019). Studie van de rol van natriumcitraat bij Bitumen Liberation. Energy Fuels 2019, 33, 8271-8278. Hersteld van pubs.ACS.borg.
- Heddle, n. en Webert, k.EN. (2007). Geneeskunde transfusie. In bloedbankieren en transfusiegeneeskunde (tweede editie). Hersteld van Scientedirect.com.
- Sudhakar, s. en Santhosh, p.B. (2017). Gouden nanomaterialen. In vooruitgang in biomembranen en lipide zelfmas. Hersteld van Scientedirect.com.
- Elsevier (redactioneel) (2018). Hoofdstuk 8. Nanometaal. In fondsen en toepassingen van nano silicium in plasmonics en fullines. Huidige en toekomstige trends Micro- en Nano -technologieën. Pagina's 169-203. Hersteld van Scientedirect.com.

