Zwaveligzuur
- 3371
- 563
- Irving McClure I
 Zwavelzuur is een mineraalzuur dat optreedt wanneer zwaveldioxide oplost in water
Zwavelzuur is een mineraalzuur dat optreedt wanneer zwaveldioxide oplost in water Wat is zwavelzuur?
Hij Zwaveligzuur Het is een oxácido die vormt wanneer zwaveldioxide, dus2, lost op in water. Het is een zwak en onstabiel anorganinezuur, dat niet in oplossing kan worden gedetecteerd, omdat de reactie van zijn vorming omkeerbaar is en het zuur snel ontleedt in de reagentia die het produceerden (dus dus2 en h₂o).
Het is een kleurloze vloeistof, met een sterke geur van zwavel, onstabiel, en wordt gebruikt in verschillende industriële velden, zoals chloorgekleurde materialen, voor de synthese van medicinale en chemische producten, voor papierproductie, of om derivaten van de aardolie te verfijnen.
Het zwavelzuurmolecuul is momenteel alleen in de gasfase gedetecteerd. De geconjugeerde basen van dit zuur zijn veel voorkomende anionen onder de vormen van sulfieten en bisulfiet.
Raman's spectrum van So Solutions2 Het toont alleen tekenen vanwege het SO -molecuul2 en bisulfiet ion, hso3-, consistent met de volgende balans:
SW2 + H₂o HSO3- + H+
Dit geeft aan dat het door het spectrum van Raman niet mogelijk is.
Wanneer het wordt blootgesteld aan de atmosfeer, wordt het snel omgezet in zwavelzuur. Zwavelzuur wordt gereduceerd tot waterstofsulfide vanwege de werking van verdund zwavelzuur en zink.
De poging om een SO -oplossing te concentreren2 Door verdamping van water om watervrij zwavelzuur te verkrijgen, produceerde het geen resultaat, omdat het zuur snel ontleedt (de vormingsreactie investeert), zodat het zuur niet kan worden geïsoleerd.
Structuur van Zwaveligzuur
 Chemische structuur van zwavelzuur
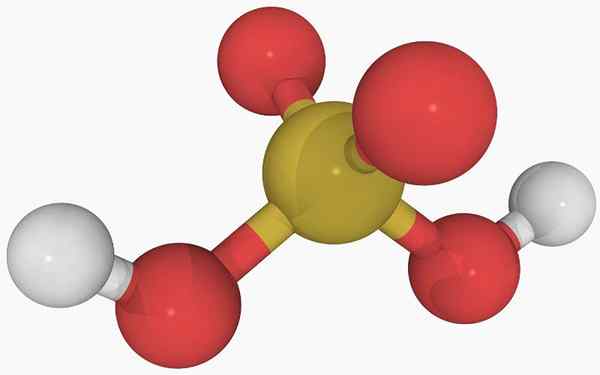
Chemische structuur van zwavelzuur In het hoofdbeeld is de structuur van een geïsoleerd molecuul van zwavelzuur in een gasvormige toestand te zien. De gele bol in het midden komt overeen met het zwavelatoom, de rood tot zuurstofatomen en wit tot hydrogenen.
Kan u van dienst zijn: diastreomerenDe moleculaire geometrie rond het S -atoom is trigonale piramide, met de atomen van of tekenen de basis.
Dan, in de gasvormige toestand, de H -moleculen2SW3 Ze kunnen worden beschouwd als microscopische trigonale piramides die in de lucht drijven, ervan uitgaande dat ze stabiel genoeg zijn om enige tijd mee te gaan zonder te reageren.
De structuur maakt duidelijk waar de twee zure hydrogenen vandaan komen: van de hydroxylgroepen gekoppeld aan zwavel, ho-oh-oh. Daarom is het voor deze verbinding niet correct om aan te nemen dat een van de zure protonen, h+, wordt vrijgelaten uit het zwavelatoom, H-SO2(OH).
De twee OH -groepen zorgen ervoor dat zwavelzuur interageert met behulp van waterstofbruggen, en ook de zuurstof van de binding s = o is een waterstofacceptor, die h maakt2SW3 zowel in een goede donor als in acceptor van deze bruggen.
Volgens het bovenstaande, h2SW3 Ik zou in een vloeistof moeten kunnen condenseren, zoals zwavelzuur, h2SW4. Niettemin, zo gebeurt het niet.
Fysische en chemische eigenschappen van de Zwaveligzuur
Moleculaire formule
H2SW3
Molecuulgewicht
82.073 g/mol.
Fysiek uiterlijk
Het is een kleurloze vloeistof, met een pittige zwavelgeur.
Dikte
1.03 g/ml.
Stoomdichtheid
2.3 (in relatie tot de lucht die is genomen als 1)
Corrosiviteit
Het is corrosief voor metalen en weefsels.
Oplosbaarheid in water
Mengbaar.
Gevoeligheid
Het is luchtgevoelig.
Stabiliteit
Stabiel, maar onverenigbaar met sterke bases.
Acidity Constant (KA)
1.54 x 10-2
Pka
1.81
pH
1.5 op de pH -schaal.
ontstekingspunt
Niet ontvlambaar.
Ontleding
Wanneer verwarmd, kan zwavelzuur worden afgebroken, waardoor een giftige rook van zwaveloxide wordt uitgezonden.
Kan u dienen: chroomhydroxide: structuur, eigenschappen, synthese, gebruikNomenclatuur
Zwavel heeft de volgende valenties: ± 2, +4 en +6. Van formule h2SW3, Het kan worden berekend welk valentie- of oxidatienummer zwavel in de verbinding heeft. Om dit te doen is het voldoende om een algebraïsche som op te lossen:
2 (+1) + 1V + 3 (-2) = 0
Omdat het een neutrale verbinding is, moet de som van de belastingen van de atomen die het vormen, 0 zijn. Als u V wist voor de vorige vergelijking, hebt u:
V = (6-2)/1
Dus is V gelijk aan +4. Dat wil zeggen, zwavel neemt deel aan zijn tweede Valencia, en volgens de traditionele nomenclatuur moet het achtervoegsel worden toegevoegd aan de naam -OOSO. Om deze reden, naar h2SW3 Het staat bekend als zwavelzuurbeer.
Een andere snellere manier om deze Valencia te bepalen, is h2SW3 met h2SW4.
In h2SW4 Sulphur heeft Valencia +6, dus als een of, Valencia naar +4 gaat, en als een andere wordt verwijderd, gaat Valencia naar +2 (wat het geval zou zijn voor zuur hikZwavelbeer, H2SW2)).
Hoewel minder bekend, aan h2SW3 Het kan ook trioxosulfurinezuur (IV) worden genoemd, volgens de voorraadnomenclatuur.
Zwavelzuurvorming in de natuur
Zwavelzuur wordt van aard gevormd vanwege de combinatie van zwaveldioxide, product van de activiteit van grote fabrieken, met atmosferisch water.
Om deze reden wordt het beschouwd als een tussenproduct van zure regen, wat grote schade aan de landbouw en het milieu veroorzaakt.
Synthese
Technisch gezien wordt zwavel gevormd om zwaveldioxide te vormen. Vervolgens lost het op in water om zwavelzuur te vormen. De reactie is echter omkeerbaar en het zuur breekt snel terug in de reactanten.
Dit is een verklaring waarom zwavelzuur niet wordt gevonden in waterige oplossing (zoals reeds vermeld in het gedeelte van de chemische structuur).
Kan je van dienst zijn: bier-lambe wetToepassingen
Over het algemeen verwijzen het gebruik en toepassingen van zwavelzuur, aangezien de aanwezigheid ervan niet kan worden gedetecteerd, het gebruik en toepassingen van zwaveldioxiden en de basis en zouten van zuur.
In hout
In het sulfietproces treedt houten pulp in de vorm van bijna pure cellulosevezels op. Verschillende zouten van zwavelzuur worden gebruikt voor de extractie van lignine uit houten splinters, met behulp van hogedrukcontainers genaamd digesters.
Desinfectiemiddel
Zwavelzuur wordt gebruikt als een desinfectiemiddel.
Bleekmiddel
Het wordt ook gebruikt als een zacht bleekmiddel, vooral voor chloorgevoelige materialen. Bovendien wordt het gebruikt als een tandheelkundig bleekmiddel en voedseladditief.
Cosmetica
Het is een ingrediënt van verschillende cosmetica voor huidverzorging en werd gebruikt als een pesticide -element bij de eliminatie van ratten. Elimineert vlekken veroorzaakt door wijn of fruit op verschillende stoffen.
Antiseptisch
Het dient als antiseptisch, is effectief om huidinfecties te voorkomen. In sommige momenten werd het gebruikt in fumigaties om schepen, bezittingen van slachtoffers van epidemieën, etc. te desinfecteren, enz.
Conserveermiddel
Zwavelzuur wordt gebruikt als een conserveermiddel voor groenten en fruit en om fermentatie van drankjes zoals wijn en bier te voorkomen, als antioxidant, antibacterieel en fungicide element.
Chemische producten
Zwavelzuur wordt gebruikt bij de synthese van medicijnen en chemicaliën, bij de uitwerking van wijn en bier, bij de verfijning van olie -afgeleide producten, en als een analytisch reagens.
Referenties
- Nomenclatuur van zuren. Hersteld van 2.Scheikunde.Gatech.Edu
- Calvo Flores, f. G. Inorganische chemie -formulering. Ugr hersteld.is

