Sulfonzuurstructuur, nomenclatuur, eigenschappen, gebruik
- 1371
- 152
- Miss Herman Russel
Het heet sulfonzuur In totaal behorende tot een familie van organische zuren met een of meer groepen -dus3H. Bepaalde auteurs geven aan dat de vaderverbinding h-s is (= o)2-Oh, of h-so3H, genoemd door een "sulfonzuur", maar het bestaan ervan is niet bewezen, noch dat van zijn HO -s tautomeer (= O) -OH bekend als "zwavelzuur" (h2SW3), noch in oplossing noch in vaste toestand.
De laatste is omdat zwaveldioxidegas (IV) (dus2) In waterige oplossing wordt het bisulfiet -ionen (HSO3-) en pyrosulfiet (s2OF52-) En niet naar h-s (= o)2-Oh of ho -s (= o) -oh, die al door veel chemische onderzoekers is bewezen.
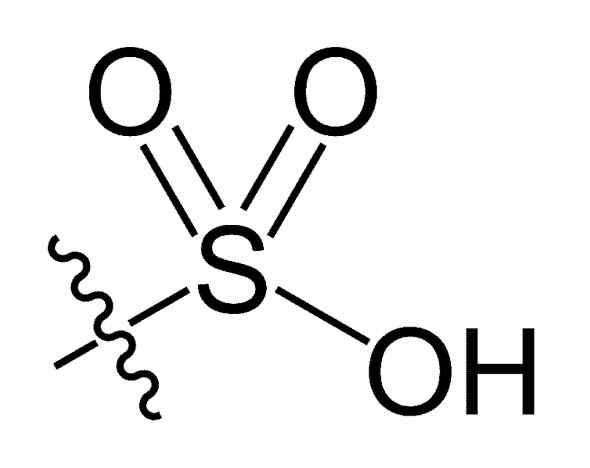
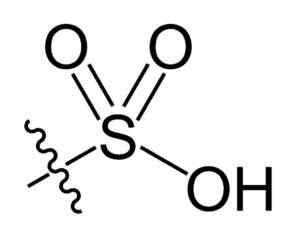 Sulfonil -groep. Choij [Public Domain]. Bron: Wikipedia Commons
Sulfonil -groep. Choij [Public Domain]. Bron: Wikipedia Commons In de R-SO chemische formule3H van sulfonzuren, groep R kan koolwaterstofskeletten vertegenwoordigen zoals alkaan, alqueno, alchene en/of zand. Deze kunnen secundaire functionaliteiten bevatten zoals ester, ether, keton, amino, amido, hydroxyl, carboxyl- en fenolgroepen, onder vele anderen.
Sulfonzuren zijn sterke zuren, vergelijkbaar met zwavelzuur (H2SW4)). De rest van zijn eigenschappen hangt echter grotendeels af van de aard van de groep R.
Sommigen hebben de neiging om bij hoge temperaturen desulfonar te ontdoen. Dit betekent het verliezen van de groep -zo3H, vooral als r een zandige is, dat wil zeggen met benzeenring.
Sulfonzuren hebben veel toepassingen, afhankelijk van hun chemische formule. Ze worden gebruikt om kleurstoffen, inkten, polymeren, wasmiddelen, oppervlakteactieve stoffen en als katalysatoren te produceren, naast vele andere toepassingen.
[TOC]
Structuur
Sulfonzuren hebben de volgende algemene structuur:
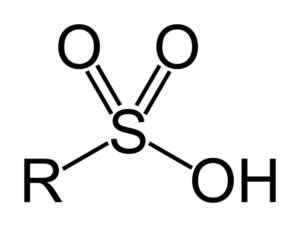 Algemene formule van sulfonzuren. Benjah-bmm27 [Public Domain]. Bron: Wikipedia Commons
Algemene formule van sulfonzuren. Benjah-bmm27 [Public Domain]. Bron: Wikipedia Commons Nomenclatuur
- Sulfonil -groep: -So3H
- Gehuurd of arilsulfonzuur: R-SO3H
Eigenschappen
Ze zijn vast of vloeistof, afhankelijk van groep R. Er zijn geen gasvormige sulfonzuren bekend.
De fysische en chemische eigenschappen zijn afhankelijk van de aard van de groep R. Als vergelijking zijn er enkele fysische eigenschappen van verschillende sulfonzuren, waarbij P.F. Het is het smeltpunt en p.En. Het is het kookpunt bij een druk van 1 mm Hg:
- Metanosulfonzuur: P.F. 20 ºC; P.En. 122 ºC
- Etanosofonzuur: p.F. -17 ºC; P.En. 123 ºC
- Proposulfonzuur: P.F. -37 ºC; P.En. 159 ºC
- Butanosulfonzuur: p.F. -15 ºC; P.En. 149 ºC
Kan u van dienst zijn: ferro chloride (FECL2): structuur, gebruik, eigenschappen- Pentosulfonzuur: p.F. -16 ºC; P.En. 163 ºC
- Hexanosulfonzuur: p.F. 16 ºC; P.En. 174 ºC
- Benzefonzuur: P.F. 44 ºC; P.En. 172 ºC (bij 0,1 mm Hg)
- P-toluensulfonzuur: P.F. 106 ºC; P.En. 182 ºC (bij 0,1 mm Hg)
- 1-naftalensulnisch zuur: P.F. 78 ºC; P.En. Het ontleedt
- 2-naftalensulfonzuur: P.F. 91 ºC; P.En. Het ontleedt
- Trifluoromethanosulfonzuur: p.F. geen; P.En. 162 ºC (bij 760 mm Hg)
De meeste zijn erg oplosbaar in water.
Sulfonzuren zijn nog meer zuren dan carbonzuren. Ze hebben zuurgraad vergelijkbaar met die van zwavelzuur. Ze lossen op in waterige natriumhydroxide en waterig bicarbonaat.
Ze hebben de neiging om thermische ontleding te ondergaan, waardoor hun desulfonatie plaatsvindt. Verschillende van de alkosulfonzuren zijn echter thermisch stabiel. In het bijzonder is trificzuur, of trifluoromethanesulfonzuur een van de sterkste en meest stabiele zuren.
Het verkrijgen van
Arilsulfonzuren
Ailsulfonzuren worden in het algemeen verkregen door het sulfonatieproces dat bestaat uit het toevoegen van een teveel aan rook zwavelzuur (h2SW4 + SW3) Tot de organische verbinding willen we sulfonar. Bijvoorbeeld in het geval van benzeen:
C6H6 + H2SW4 C6H5SW3H + H2OF
Arh + H2SW4 Arso3H + H2OF
Sulfonatie is een omkeerbare reactie, want als we aan benzeulfonzuur een verdund zuur toevoegen en stoom op het mengsel passeren3 En benzeen wordt gedestilleerd door vervluchtiging met stoom, waardoor de balans naar desulfonatie worden verplaatst.
Het sulfonantmiddel kan ook chloorsulfurinezuur, sulfaminezuur of sulfietionen zijn.
Alkylofonzuren
Deze worden over het algemeen bereid door sulfo-oxidatie, dat wil zeggen behandeling van alkylverbindingen met zwaveldioxide dus2 en zuurstof of2, of direct met zwaveltrioxide dus3.
RH + 2SO2 + OF2 + H2Of r-so3H + H2SW4
Toepassingen
Sulfonzuren voor oppervlakteactieve stoffen en wasmiddelen
Alkybenfinezuren worden gebruikt bij de vervaardiging van wasmiddelen, zijn een van de meest voorkomende toepassingen.
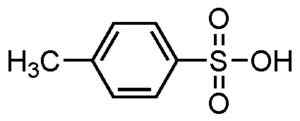 P-methylbenzefonzuur. Su-no-g. Bron = zelfgemaakt. *Datum = 21 aug 2006. *Gemaakt met chemdraw. Bron: Wikipedia Commons.
P-methylbenzefonzuur. Su-no-g. Bron = zelfgemaakt. *Datum = 21 aug 2006. *Gemaakt met chemdraw. Bron: Wikipedia Commons. Ze worden gebruikt voor poedervormige en vloeibare wasmiddelen, wasmiddelen voor zware of lichte taken, handen en shampoo -zeep.
De actieve componenten zijn over het algemeen de alkybenzeen lineaire en gesulfoneerde vetesters.
Aangezien oppervlakteactieve stoffen veel voorkomende alfa-olefinesulfonaten, sulfobetines, sulfosuccinaten en gehuurde Étere diffenilisch diffenilisch, die allemaal zijn afgeleid van sulfonzuren.
Kan u van dienst zijn: natriumoxalaat (NA2C2O4): structuur, eigenschappen, gebruik, risico'sDeze oppervlakteactieve stoffen vinden gebruik bij het reinigen van huishoudens, cosmetica, polymerisatie in emulsies en chemische productie voor landbouw.
De ligosulfonaten zijn afgeleid van lignine, een component van hout, en worden gebruikt als verspreiding, hydraterende, bindmiddelen in wegverhogingen, betonnen additieven en additieven in dierlijke voedingsmiddelen.
Een afgeleid van 2-naftalanosulfonzuur wordt gebruikt om de vloeibaarheid en sterkte van cement te verhogen.
Sulfonzuur -gebaseerde kleuren
Deze worden over het algemeen gekenmerkt door AZO-groepen te bevatten (R-N = N-R).
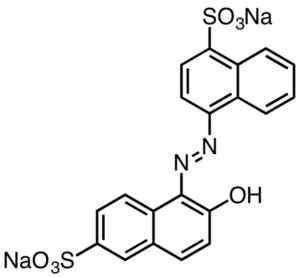 Zuurrode kleur. Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons.
Zuurrode kleur. Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons. Sulfonzuur afgeleide kleurstoffen hebben nut in de papieren industrie, inkten zoals injectieafdrukken, textiel zoals katoen en wol, cosmetica, zeep, wasmiddelen, voedsel en leer.
Een 2-naftalanosulfonzuurderivaat wordt ook gebruikt als een kleuringrediënt voor polyestervezels en lederen zonnebank.
Amiden op basis van sulfonzuren
Deze toepassing benadrukt de acrylamidefonzuren, die polymeren hebben, in metaalelektrode, zoals oppervlakteactieve stoffen en in transparante anti -companies coatings.
Ze worden ook gebruikt in verbeterde oliewinning, als verbindings -liberatiemiddelen op grond, in hydraulische cementmengsels en als aminoplastische harsen die versnellers genezen.
Sommige sulfonamiden worden ook gebruikt in insecticideformules.
Gefluoreerde en chlorofluor sulfonzuren
Deze groep benadrukt het trifluoromethanosulfonzuur (CF3SW3H), ook wel trifzuur genoemd. Deze verbinding heeft een organische synthese en polymerisatiereacties katalyse.
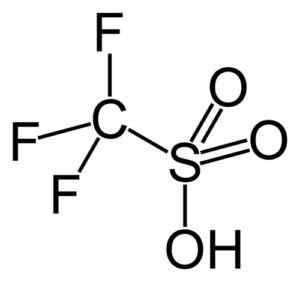 Trischzuur. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons.
Trischzuur. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons. Het wordt bijvoorbeeld gebruikt bij de polymerisatie van aromatische olefines en bij het bereiden van sterk vertakte paraffine koolwaterstoffen met een hoog octaannummer om ze als brandstofadditieven te gebruiken.
Een andere van de toepassingen is in de synthese van geleidende polymeren, door middel van polyacethyleendoping, die bijvoorbeeld type halfgeleiders produceren P.
Pentafluoroetanosulfonzuur (CF3CF2SW3H), bekend als pentaplinezuur, wordt gebruikt als organische katalysator.
Trific Acid reageert met antimoon pentafluoride (SBF5) het genereren van het zo -aangedekte "magische zuur", een super -acid katalysator die dient voor alkylering en polymerisatie.
Kan u van dienst zijn: jodiumtinctuur: eigenschappen, gebruik, contra -indicatiesNafion-H is een ionenuitwisselinghars van een geparfumeerd polymeersulfonzuur. Het heeft het kenmerk van inert te zijn in de richting van sterke zuren, sterke basen en reducerende of oxidatiemiddelen.
In biologische toepassingen
Een van de weinige sulfonzuren die in de natuur worden gevonden, is 2-aminoethanosulfonzuur, beter bekend als stierengevechten, een in wezen aminozuur, met name voor katten.
Synthetische en natuurlijke stierenvechten worden gebruikt als supplementen in voedsel voor huisdieren en farmaceutische producten.
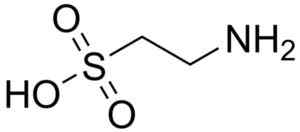 Stierenmolecuul. Koester. Bron: Wikipedia Commons
Stierenmolecuul. Koester. Bron: Wikipedia Commons Taurocolzuur is een galcomponent en neemt deel aan de spijsvertering van vetten. 8-anilino-1-naftalanosulfonzuur, een synthetische verbinding, wordt gebruikt in de studie van eiwitten.
Ureumcopolymeren en bifenyldisulfonzuur zijn gebruikt als herpes simplex -virusremmers.
Sommige sulfonzuurderivaten, zoals gesulfoneerd polystyreen en sommige azocompiestos, hebben remmingseigenschappen van menselijke immunodeficiëntie of HIV -virus aangetoond, zonder overmatig toxisch te zijn tegen gastheercellen.
In de olie -industrie
Bepaalde mengsels van oliedivaten, waaronder een gevarieerde combinatie van aromatische, paraffines en polynucleaire aromatisch, kunnen worden gesulfoneerd en vervolgens correct geneutraliseerd door de zo -gekalde oliesulfonaten te genereren.
Deze oliesulfonaten hebben de eigenschap om de chirurgiespanning in water te verlagen. Bovendien is de productie zeer lage kosten.
Om deze reden worden oliesulfonaten geïnjecteerd in bestaande oliebronnen die helpen bij het herstel van ruwe olie die tussen rotsen onder het oppervlak wordt afgesloten.
In de formulering van smeermiddelen en anticorrosief
Magnesiumsulfonaten worden breed gebruikt in smeermiddelenformules zoals verspreidingspersende additieven en om slijtage te voorkomen.
Bariumsulfonaten worden gebruikt in anti -flintsmeermiddelen voor gebruik die wordt gebruikt in toepassingen met hoge snelheid. Natrium- en calciumsulfonaten hebben smeermiddelen en vetvetten om de eigenschappen van de extreme druk te verbeteren.
Sulfonzuur magnesiumzouten zijn ook nuttig in anticorrosieve toepassingen zoals coatings, vetten en harsen.
Referenties
- Falk, Michael en Giguere, Paul A. (1958). Over de aard van zwavelzuur. Canadian Journal of Chemistry, Vol. 36, 1958. Hersteld van nrcreseakpress.com
- Betts, r.H. en Voss, r.H. (1970). De kinetiek van zuurstofuitwisseling tussen het sulfietion en water. Canadian Journal of Chemistry, Vol. 48, 1970. Hersteld van nrcreseakpress.com
- Katoen, f.NAAR. En Wilkinson, G. (1980). Geavanceerde anorganische chemie. Vierde druk. Hoofdstuk 16. John Wiley & Sons.
- Kirk-othmer (1994). Encyclopedie van chemische technologie. Deel 23. Vierde druk. John Wiley & Sons.
- Kosswig, Kurt. (2012). Oppervlakteactieve stoffen. Ullmann's Encyclopedia of Industrial Chemistry Vol. 35. Wiley-VCH Verlag GmbH & Co.
- « Chloordioxide (CLO2) structuur, gebruik, verkrijgen, risico's, eigenschappen
- Polyactzuurstructuur, eigenschappen, synthese, gebruik »

