Chloordioxide (CLO2) structuur, gebruik, verkrijgen, risico's, eigenschappen

- 1196
- 244
- Alton D'Amore
Hij chloordioxide Het is een anorganische verbinding gevormd door het chloorelement (CL) en zuurstof (O). De chemische formule is clo2. Het is een groenachtig tot roodachtig geel gas. Het wordt niet van nature in de omgeving gevonden.
Het is extreem reactief, dus het is gebruikelijk dat het wordt voorbereid op de plaats waar het zal worden gebruikt. Een van de belangrijkste toepassingen is als microbicide, antiseptisch en deodoriserend omdat het zeer gemakkelijk bacteriën, virussen en schimmels elimineert en in zeer lage concentraties.
 Sommige voedingsmiddelen die in supermarkten worden verkocht, zijn mogelijk gedesinfecteerd met Clo -chloordioxide2. Auteur: ElasticComputefarm. Bron: Pixabay.
Sommige voedingsmiddelen die in supermarkten worden verkocht, zijn mogelijk gedesinfecteerd met Clo -chloordioxide2. Auteur: ElasticComputefarm. Bron: Pixabay. Het maakt het mogelijk om voedsel zoals groenten, fruit, vlees, vogels en zeevruchten te desinfecteren. Het dient om oppervlakken, vloeren, badkamers, ventilatiesystemen, zwembaden, laboratoriumapparatuur, tandartsapparatuur, etc. te hygiëniseren, enz.
Daarom wordt het gebruikt in voedselverwerking, in ziekenhuizen en klinieken, in industrieën en winkels. Het wordt gebruikt om het water te zuiveren dat wordt gebruikt om te drinken en ook een gemeentelijk afvalwater.
Het is zeer effectief als een oxidatiemiddel, dus het wordt gebruikt om papieren pulp, oliën, bloem, leer, textielvezels te bleken, onder andere.
Wanneer het in de vorm van gas is, is het erg gevaarlijk, omdat het erg explosief is en voornamelijk wordt gebruikt in waterige oplossingen. Het is giftig als het inademt.
[TOC]
Structuur
Chloordioxide wordt gevormd door de vereniging van een chlooratoom (CL) met twee zuurstofatomen (O). Chloorverbindingen met elke zuurstof zijn covalent en dubbel. Het chloor in deze verbinding heeft een valentie van +4.
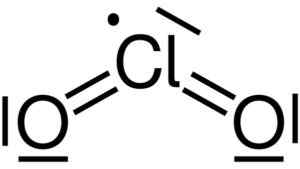 Lewis -structuur van chloordioxide2. Yikrazuul [Public Domain]. Bron: Wikimedia Commons.
Lewis -structuur van chloordioxide2. Yikrazuul [Public Domain]. Bron: Wikimedia Commons. Het heeft een symmetrische en hoekvormige structuur, omdat het vrije elektronen heeft. Dat wil zeggen, ze vormen geen link met een ander atoom.
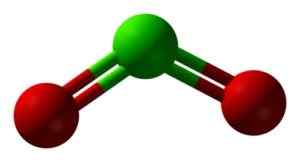 Clo -structuur2 in drie dimensies. Groen = chloor; Rood = zuurstof. Ben Mills en Jynto [Public Domain]. Bron: Wikimedia Commons.
Clo -structuur2 in drie dimensies. Groen = chloor; Rood = zuurstof. Ben Mills en Jynto [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
- Chloordioxide
- Chlooroxide (IV)
Eigenschappen
Fysieke staat
Groenachtig geel tot roodachtig geel gas.
Molecuulgewicht
67,45 g/mol.
Smeltpunt
-59 ºC.
Kookpunt
11 ºC.
Dikte
Vloeistof bij 0 ° C = 1,642 g/cm3
Gas = 2,33 (luchtrelatieve dichtheid, lucht = 1).
Het kan u van dienst zijn: ISOAMYL Alcohol: structuur, eigenschappen, gebruik en risico'sOplosbaarheid
Water oplosbaar: 2000 cm3 van de clo2 gas bij 100 cm3 koud water of 0,8 g/100 ml water bij 20 ° C. Oplosbaar in alkalische oplossing en in zwavelzuuroplossing h2SW4.
Chemische eigenschappen
De clo2 Het is extreem reactief en kan gewelddadig exploiteren. Het is een zeer effectief oxidatiemiddel.
De clo2 Het breekt heftig als het in contact komt met organische materialen. Als u in lucht bent in een concentratie groter dan 10%, kan het ontploffen vanwege zonlicht of warmte.
U kunt ook ontploffen in aanwezigheid van kwik (HG) of koolmonoxide (CO).
Onder de werking van ultraviolet (uv) of ozon de clo2 Het wordt chloor hexoxide2OF6, zeer onstabiele verbinding.
Eigenschappen van uw waterige oplossingen
Zijn waterige oplossingen zijn geel of roodachtig geel. Ze zijn stabiel als ze koud, goed afgedicht en beschermd tegen zonlicht blijven. In aanwezigheid van licht worden deze oplossingen langzaam afgebroken om HCl -zoutzuur en HCLO -chloorzuur te geven3.
 Wateroplossing van clo2 waar wordt opgemerkt dat een geel gas wordt vrijgegeven dat de clo is2. Auteur: materiaalwetenschapper. Bron: Wikimedia Commons.
Wateroplossing van clo2 waar wordt opgemerkt dat een geel gas wordt vrijgegeven dat de clo is2. Auteur: materiaalwetenschapper. Bron: Wikimedia Commons. In de alkalische oplossingen de clo2 Het is opgesplitst in ionen chlorite clo2- en Clorate3-. In zure oplossingen vormt chloorzuur HCLO2 En dan wordt dit afgebroken tot HCl -zoutzuur en HCLO -chloorzuur3.
Andere eigenschappen
De geconcentreerde dampen van Clo2 Ze zijn potentieel explosief, dus het is niet mogelijk geweest om niet alleen te comprimeren alleen gemengd met andere gassen. Om deze reden heeft het de voorkeur om het voor te bereiden op de site waar het zal worden gebruikt.
Wanneer het zeer lage temperaturen zijn in zijn gehydrateerde vorm, die de manier is waarop het soms wordt overgebracht, is het een vaste stof in de vorm van een ijsblok en oranje.
Het heeft een geur vergelijkbaar met chloor. Is giftig door inademing.
Het verkrijgen van
Kan op verschillende manieren worden verkregen. In sommige gevallen bijvoorbeeld de CLO -oplossingen2 Ze bereiden zich voor om een mengsel van chloorgas door te geven (CL2) en lucht (of chloor- en stikstofgas2) door een kolom die natriumchlorietkorrels bevat (NaClo2)).
Kan u van dienst zijn: Valencia -laag2 Naclo2 + Klet2 → 2 NaCl + 2 clo2
Het gegenereerde product bevat ongeveer 90% clo2, Onder andere chloorverbindingen.
Het wordt ook verkregen van kaliumchloraat (KCLO3) en zwavelzuur (h2SW4) In aanwezigheid van oxaalzuur als reducer. In dit geval wordt ook koolstofdioxide gevormd (CO2) die dient om de clo te verdunnen2.
Het kan worden voorbereid op de gebruikslocatie op basis van natriumchloraat (NACLO3), zwavelzuur (h2SW4) en methanol (kies3OH).
In de industrie wordt het verkregen door natriumchloraat (NACLO3) en zwaveldioxide (dus2) In aanwezigheid van zwavelzuur.
2 Naclo3 + SW2 + H2SW4 → 2 clo2 + 2 Nahso4
Gebruik als desinfectiemiddel
Het kan worden gebruikt als een krachtig antimicrobieel middel. Het is gebleken dat het zeer effectief is tegen verschillende micro -organismen, zoals Escherichia coli en de Staphylococcus aureus.
Met deze laatste, een concentratie van slechts 5 ppm clo2 Om 100% van hen te elimineren. Het is bactericide, antiseptisch en ontgegend. Het is effectief op een breed pH -interval.
In eten
Het wordt gebruikt als een antimicrobieel middel in water om groenten en groenten te fumigeren, bij de verwerking van vogels van vogels, rood vlees, beide stukken vlees en organen, en mariene producten en zeevruchten.
 Het rode vlees van supermarkten kan zijn behandeld met chloordioxide om ze te desinfecteren. Auteur: Karamo. Bron: Pixabay.
Het rode vlees van supermarkten kan zijn behandeld met chloordioxide om ze te desinfecteren. Auteur: Karamo. Bron: Pixabay. Chloordioxide -oplossingen moeten worden gebruikt in een concentratie die niet groter is dan 3 ppm (partijen per miljoen) clo2 rest, zodat het geen effect heeft op voedsel.
Na behandeling met Clo2 Alle voedingsmiddelen moeten volledig worden geregeerd met drinkwater, of moeten worden gebruikt als gebrand, koken of ingeblikt.
In het geval van mariene producten de riooloplossing2 Het moet worden gebruikt in het water en het ijs die worden gebruikt in het spoelen, wassen, ontdooien, transport of opslag. Rauwe zeevruchten moeten dan heel goed worden gewassen met drinkwater vóór consumptie.
 Koud water en ijs waarmee zeefruit kleine hoeveelheden clo bevat2. Auteur: Public DomainPartures. Bron: Pixabay.
Koud water en ijs waarmee zeefruit kleine hoeveelheden clo bevat2. Auteur: Public DomainPartures. Bron: Pixabay. Op papier en karton dat in contact komt met voedsel
Clo Solutions2 Ze worden gebruikt om micro -organismen te elimineren die slank (zoals algen, bacteriën en schimmels) veroorzaken in het proces dat wordt gebruikt bij de vervaardiging van papier en karton dat in contact komt met voedsel.
Kan u van dienst zijn: apolaire moleculenIn drinkwater
Het dient om water te zuiveren en drinkbaar te maken (veilig om te drinken). Het wordt gebruikt in voorbehandeling met water die dan zal worden gebotteld om te drinken of water dat zal worden gebruikt als ingrediënt bij de vervaardiging van drankjes of frisdranken.
 Sommige verwerkte frisdranken kunnen behandeld water met clo bevatten2. Susan Slater [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Sommige verwerkte frisdranken kunnen behandeld water met clo bevatten2. Susan Slater [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. In tandheelkunde
Het wordt gebruikt in de instrumenten die door de tandarts of tandarts worden gebruikt om ze te desinfecteren en pathogene organismen erin te vernietigen.
In medische toepassingen
De waterige oplossingen van clo2 Ze zijn gebruikt om orale candidiasis (mondinfectie) te behandelen. Candidiasis is een schimmelinfectie Candida albicans.
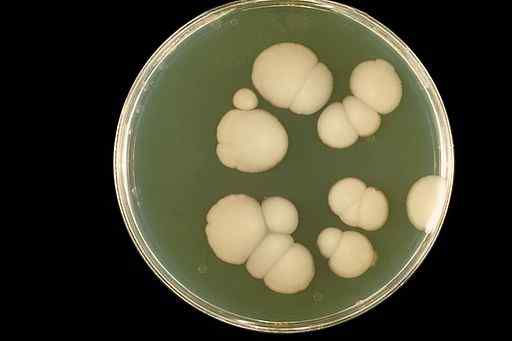 Candida albicans schimmel verschijning in een laboratoriumgewas. CDC/DR. William Kaplan [Public Domain]. Bron: Wikimedia Commons.
Candida albicans schimmel verschijning in een laboratoriumgewas. CDC/DR. William Kaplan [Public Domain]. Bron: Wikimedia Commons. Chloordioxide elimineert de mond uit de mond en verbetert het uiterlijk van orale weefsels aanzienlijk zonder bijwerkingen.
Sommige medische onderzoekers geven aan dat CLO -oplossingen2 Toegepast op chirurgische bewerkingswonden, kunnen ze de vorming van accessies verminderen of onderdrukken zonder de genezing daarvan te beïnvloeden, met het extra voordeel van zijn antiseptische eigenschappen.
Andere gebruiken
Voor zijn oxiderende en microbicide eigenschappen de clo2 is gebruikt voor:
- Bleek de cellulose van het hout bij de vervaardiging van pulp en papier, waardoor een stabiele glans wordt gegeven.
- Decoreer vetten en oliën, leer, wit bloem en textiel.
- Landbouwtoepassingen zoals het desinfecteren van harde oppervlakken, apparatuur, watersystemen en champignonkassen.
- Toepassingen in industrieën, winkels en ziekenhuizen zoals het desinfecteren van harde oppervlakken (muren, vloeren, badkamers), ventilatiesystemen, laboratoriumapparatuur.
- Desinfectieve flats en badkamers van huishoudens, airconditioningsystemen, zwemwatercirculatiesystemen.
- De behandeling van gemeentelijk en industrieel afvalwater.
- Vervuiling van olievelden.
- Productie van chloridezouten (Cl-)).
Risico's
- De geconcentreerde dampen van Clo2 Ze zijn potentieel explosief.
- Het is giftig door inademing en inname. Het irriteert oog, neus en keel, kan longoedeem en chronische bronchitis veroorzaken.
- Volgens de bronnen hebben de CLO geraadpleegd2 veroorzaakt geen DNA -mutaties of veroorzaakt kanker bij mensen.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Chloordioxide. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Dean, J.NAAR. (editor). (1973). Lange's Handbook of Chemistry (elfde editie). McGraw-Hill Book Company.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. VCH VerlagSgellschaft MBH.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Bajpai, p. (2012). Chloordioxide bleken. Effect van chloordioxide -bleken op pulpkwaliteit. In milieuvriendelijke benaderingen voor pulp bleekmiddel (tweede editie). Hersteld van Scientedirect.com.
- Moran, s. (2018). Waterchemie. Chloordioxide. In een toegepaste gids voor het ontwerp van water en effluent behandelingsinstallaties. Hersteld van Scientedirect.com.
- McKen, L. (2012). Inleiding tot FoodRadition en Medical Sterilization. Gasoous chorine diexide. In het effect van sterilisatie op kunststoffen en elastomeren (derde editie). Hersteld van Scientedirect.com.
- « Bovenste paleolithische kenmerken, kunst, sociale organisatie
- Sulfonzuurstructuur, nomenclatuur, eigenschappen, gebruik »

