Selenhydriczuur (H2SE) Wat is, structuur, eigenschappen, gebruik
- 3118
- 59
- Kurt Aufderhar Jr.
 Waterstof seleniuro: twee waterstofmoleculen en een van selenium
Waterstof seleniuro: twee waterstofmoleculen en een van selenium Wat is selenhydrinezuur?
Hij Selenhydrinezuur o waterstof seleniuro is een anorganische verbinding waarvan de chemische formule h is2HIJ. Het is van covalente aard en in gewone temperatuur- en drukomstandigheden is het een kleurloos gas; Maar met een sterke herkenbare geur van zijn kleine aanwezigheid. Chemisch gezien is het een tracting, dus het selenium heeft Valencia van -2 (i2-)).
Van alle seleniuros, h2Het is het meest giftig omdat het molecuul klein is en het seleniumatoom minder sterisch belemmering heeft bij het reageren. Aan de andere kant kan de geur degenen die ermee samenwerken, het in het geval van een buiten het laboratoriumklok detecteren.
Waterstof seleniuro kan synthetiseren door de directe combinatie van zijn twee elementen: moleculaire waterstof, h2, en metalen selenium. Het kan ook worden verkregen door verbindingen op te lossen die rijk zijn aan selenium, zoals ijzer seleniuro (ii), fese, in zoutzuurzuur.
Aan de andere kant wordt selenhydriczuur bereid door waterstof seleniuro in water op te lossen; Dat wil zeggen, de eerste wordt opgelost in het water, terwijl de tweede bestaat uit frisdranken.
Het belangrijkste gebruik is om een bron van selenium te zijn in de organische en anorganische synthese.
Waterstof seleniuro structuur
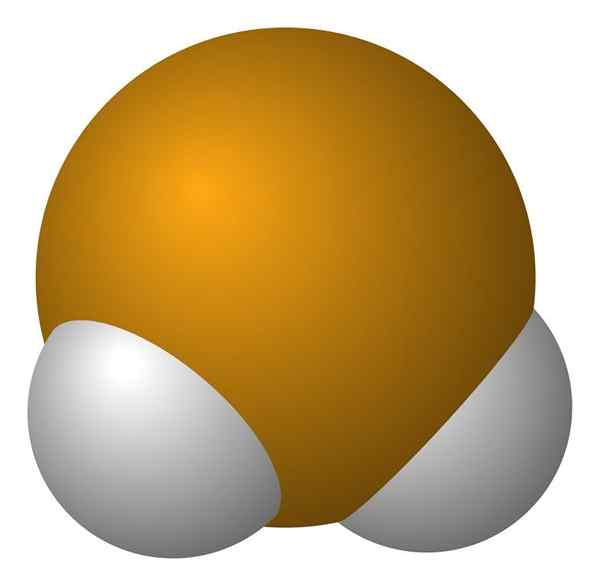
 Waterstof seleniuro molecuul. Wikimedia Commons.
Waterstof seleniuro molecuul. Wikimedia Commons. De H Molecula2Het is van hoekige geometrie, hoewel de hoek van 91 ° het meer op een L lijkt dan op een V. In dit model van bollen en staven zijn waterstofatomen en selenium respectievelijk de witte en gele bollen.
Dit molecuul, zoals getoond, is degene die zich in een gasfase bevindt; dat wil zeggen voor waterstof seleniuro. Bij het oplossen in water brengt het een proton vrij en in oplossing heb je het paar hse- H3OF+; Dit ionkoppel komt naar Selenhydric Acid, aangeduid als h2SE (AC) om het te differentiëren van waterstof seleniuro, h2SE (G).
Kan u van dienst zijn: methyleenblauw: kenmerken, voorbereiding, gebruik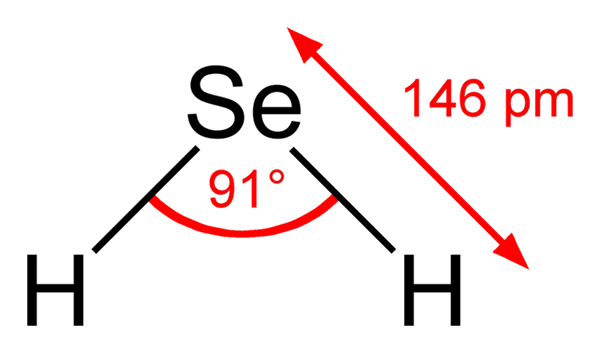 Structurele formule van seleenhydrinezuur. Ben Mills, Wikimedia Commons ..
Structurele formule van seleenhydrinezuur. Ben Mills, Wikimedia Commons .. Daarom zijn de structuren tussen h2SE (AC) en H2SE (G) zijn heel anders; De eerste is omgeven door een waterige bol en heeft ionische belastingen, en de tweede bestaat uit een agglomeraat van gasfasemoleculen.
De H -moleculen2Ze kunnen nauwelijks met elkaar communiceren door zeer zwakke krachten Dipolo-Dipolo. Het selenium, hoewel het minder elektronegatief is dan zwavel concentreert een grotere elektronische dichtheid om het "te snikken" van waterstofatomen.
Selenio Hyduues gecomprimeerd
Als H Moleculen2Ze ondergaan buitengewone druk (honderden GPA), theoretisch worden ze gedwongen te stollen door SE-H-SE-links te vormen; Dit zijn links van drie centra en twee elektronen (3C-2E) waar waterstof deelneemt. Daarom beginnen moleculen polymere structuren te vormen die een vaste stof definiëren.
Onder deze omstandigheden kan de vaste stof met meer waterstof worden verrijkt, wat de resulterende structuren volledig wijzigt. Bovendien wordt de compositie type hNSE, waar N varieert van 3 tot 6. Aldus hebben seleniumhydriden gecomprimeerd door deze druk, en in aanwezigheid van waterstof, hebben chemische formules h3Ik weet h h6HIJ.
Naar schatting zijn deze seleniumhydroren verrijkt met waterstof supergeleidende eigenschappen.
Eigenschappen
Fysiek uiterlijk
Kleurloos gas dat bij lage temperaturen ruikt naar putracto en rotte eieren als de concentratie toeneemt. De geur is erger en intenser dan het waterstofsulfide (dat al behoorlijk onaangenaam is). Dit is echter goed, omdat het helpt bij de gemakkelijke detectie en langdurig contact of inademingsrisico's afneemt.
Wanneer het brandt, geeft het een blauwachtig vlamproduct af van elektronische interacties in seleniumatomen.
Kan u van dienst zijn: zwaveloxideMoleculaire massa
80,98 g/mol.
Kookpunt
-41 ° C.
Smeltpunt
-66 ° C.
Dampdruk
9,5 atm bij 21 ° C.
Dikte
3.553 g/l.
Pknaar
3.89.
Oplosbaarheid in water
0,70 g/100 ml. Dit bevestigt het feit dat het seleniumatoom van h2U kunt geen waterstofbruggen die merkbaar zijn met watermoleculen.
Oplosbaarheid in andere oplosmiddelen
-Oplosbaar in CS2, wat niet verwonderlijk is door de chemische analogie tussen selenium en zwavel.
-Phosgen oplosbaar (bij lage temperaturen, omdat het kookt bij 8 ° C).
Nomenclatuur
Zoals uitgelegd in eerdere secties, varieert de naam van deze verbinding afhankelijk van of h2Het bevindt zich in een frisdrank of opgeloste fase in water. Als het in water is, is er sprake van seleenhydriczuur, dat niets meer is dan een hydrie in anorganische termen. In tegenstelling tot gasmoleculen is het zure karakter groter.
Hetzij als gas of opgelost in water, handhaaft het seleniumatoom echter dezelfde elektronische kenmerken; De Valencia is bijvoorbeeld -2, tenzij u een oxidatiereactie lijdt. Deze Valencia van -2 is de reden waarom het seleni wordt genoemdoeros van waterstof, omdat het seleniuro -anion de2-; die reactiever en reductiemiddel is dan de S2-, sulfide.
Als systematische nomenclatuur wordt gebruikt, moet het aantal waterstofatomen in de verbinding worden gespecificeerd. Dus h2Het wordt genoemd: seleniuro van gafwaterstof.
Seleniuro of hydride?
Sommige bronnen noemen hem een hydride. Als het werkelijk was, zou het selenium positieve lading +2 hebben en de waterstof negatieve belasting -1: seh2 (HIJ2+, H-)). Selenium is een meer elektronegatief atoom dan waterstof, en eindigt daarom de hoogste elektronische dichtheid in de H -molecuul "monopoliseren"2HIJ.
Kan u van dienst zijn: thermochemieAls zodanig kan het bestaan van seleniumhydride echter niet worden weggegooid. In feite, met de aanwezigheid van H -anionen- Het zou SE-H-SE-links vergemakkelijken, verantwoordelijk voor vaste structuren die zijn gevormd tot enorme druk volgens computerstudies.
Toepassingen
Metabolisch
Hoewel het tegenstrijdig lijkt, ondanks de grote toxiciteit van H2SE, het wordt in het lichaam geproduceerd op de metabole route van het selenium. De cellen worden echter nauwelijks geproduceerd als een intermediair in het syntium van selenioproteïnen, of worden uiteindelijk gemethyleerd en uitgescheiden; Een van de symptomen hiervan is de knoflooksmaak in de mond.
Industriëlen
De H2Het wordt voornamelijk gebruikt om seleniumatomen toe te voegen aan vaste structuren, zoals halfgeleidermaterialen; naar organische moleculen, zoals alkenen en nitrillen voor de synthese van organische seleniuros; of naar een oplossing om metallic seleniuros neer te slaan.
Referenties
- Waterstof selenide. Opgehaald uit: in.Wikipedia.borg
- Waterstof selenide, h2HIJ. Hersteld van: selenium.Atomie.com

