Propaanzuur
- 1498
- 314
- Dewey Powlowski
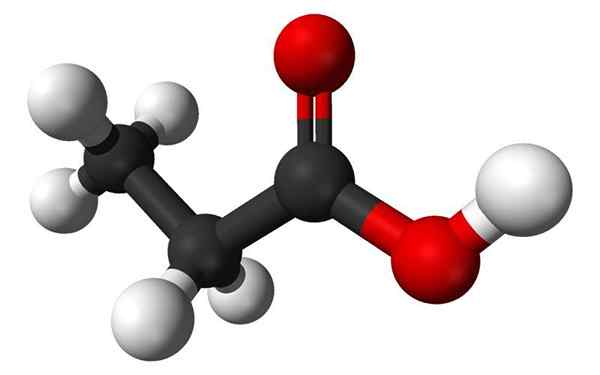
 Propaanzuurmolecuul in een bar- en bollenmodel. Bron: Benjah-Bmm27, Wikimedia Commons
Propaanzuurmolecuul in een bar- en bollenmodel. Bron: Benjah-Bmm27, Wikimedia Commons Wat is propaanzuur?
Hij Propaanzuur, Ook wel propionics genoemd, het is een verzadigd kort -ketenvetzuur dat koolstof -aangetast ethaan uit een carboxy -groep omvat. Zijn formule is Cho3-Ch2-COOH.
Het CH3CH2COO -anion, evenals de zouten en esters van propaniczuur, staan bekend als aandeel (of propanoats).
Het kan worden verkregen uit houten pulpresiduen door fermentatieproces, met behulp van genderbacteriën Propionibacterium. Het wordt ook verkregen uit ethanol en koolmonoxide, met behulp van een boor trifluoride katalysator.
Een andere manier om propaanzuur te verkrijgen is te wijten aan de oxidatie van een aandeel in aanwezigheid van kobalt- of mangaanionenionen. Deze reactie ontwikkelt zich snel bij temperaturen zo laag als 40-50 ° C:
2CH3Ch2Cho + O2 → 2CH3Ch2COOH
De verbinding is van nature aanwezig op lage niveaus in zuivelproducten en komt op een algemene manier voor, samen met andere vetzuren met korte ketens, in het maagdarmkanaal van mensen en andere zoogdieren als een eindproduct van de microbiële digestie van koolhydraten.
Fysische en chemische eigenschappen
- Propaanzuur is een kleurloze en olieachtige vloeistof, met een hectare, onaangename en ranzige geur.
- Het heeft een molecuulgewicht van 74,08 g/mol en een dichtheid van 0,992 g/ml.
- Het vriespunt en het kookpunt zijn respectievelijk -20,5 ° C en 141,1 ° C, respectievelijk.
- Propaanzuur is een zwak zuur, waarvan de PKA 4,88 is.
- De verbinding is zeer oplosbaar in water en kan 34,97 gram oplost die uit elke 100 ml oplosmiddel is samengesteld. Het is ook oplosbaar in ethanol, ether en chloroform.
Kan u van dienst zijn: organische verbindingen: kenmerken, classificatie, voorbeelden- Het heeft tussenliggende fysische eigenschappen tussen die van kleinere carbonzuren, formische en azijnzuren en grotere vetzuren.
- Het toont de algemene eigenschappen van carbonzuren en kan amide-, ester-, anhydride- en chloridederivaten vormen.
- U kunt een alfa-halogenering met Bromo ondergaan in aanwezigheid van PBR3 als een katalysator (de HVZ-reactie) om CH3CHBRCOOH te vormen.
Reactiviteit en gevaren
Propaanzuur is een brandbaar en brandstofmateriaal. Het kan worden verlicht door hitte, vonken of vlammen. De dampen kunnen explosieve mengsels vormen met de lucht, kunnen reizen naar de bron van ontsteking en exploiteren.
De meeste dampen zijn zwaarder dan lucht. Ze worden over de grond uitgebreid en worden verzameld in lage of beperkte gebieden (riolen, kelders, tanks). Binnen-, buiten- of rioolexplosie gevaar of rioleringen.
Stoffen die zijn aangeduid met een (P) kunnen exploDatief polymeer zijn. Containers kunnen exploderen wanneer verwarmd.
De verbinding moet worden weggehouden van hitte of ontstekingsbronnen. Wanneer verwarmd tot ontleding stoten acre rook uit en irriterende dampen.
Propaanzuur is irritant voor huid, ogen, neus en keel, maar produceert geen acute systemische effecten en heeft geen aantoonbaar genotoxisch potentieel. In geval van contact moet u met veel water wassen.
Biochemie
De geconjugeerde basis van propaniczuur, het propionaat, wordt gevormd als het driekoolstof eindfragment (geactiveerd met co-enzym tot zoals propionyl-CoA) bij de oxidatie van de vetzuren van ImpAR-getal en de oxidatie van de laterale keten van de laterale keten van de laterale keten van het cholesterol.
Kan u van dienst zijn: ionisatieconstanteExperimenten met radioactieve isotopen van propionaat geïnjecteerd in nuchtere ratten geven aan dat het kan verschijnen in glycogeen, glucose, tussenproducten van de citroenzuurcyclus, aminozuren en eiwitten.
Propanoïnezuurmetabolisme Route impliceert interactie met co-enzym A, carboxylering om methylmalonyl-co-enzyme A te vormen en conversie naar succininezuur, dat de citroenzuurcyclus binnenkomt.
Propaanzuur kan oxideren zonder ketonlichamen te vormen en, in tegenstelling tot azijnzuur, is opgenomen in een koolhydraat, evenals een lipide.
Propioninezuur is een van de meest voorkomende organische zuren, een ziekte die veel verschillende aandoeningen omvat.
Het resultaat van patiënten geboren met propionzuur is slecht in intellectuele ontwikkelingspatronen, met 60% die een intellectuele coëfficiënt heeft minder dan 75 en die speciaal onderwijs vereisen.
Lever- en/of succesvolle niertransplantaties bij enkele patiënten hebben geresulteerd in een betere kwaliteit van leven, maar hebben niet noodzakelijkerwijs neurologische en ingewikkelde complicaties voorkomen.
Deze resultaten benadrukken de noodzaak van permanente metabole monitoring, ongeacht de therapeutische strategie.
Toepassingen
- Propaanzuur remt bacteriële en schimmelgroei bij niveaus tussen 0,1 en 1% per gewicht. Als gevolg hiervan wordt het grootste deel van het geproduceerde propaanzuur geconsumeerd als een conserveermiddel voor zowel voeder- als menselijke consumptie -voedingsmiddelen, zoals granen en granen.
- Ongeveer 51% van het wereldverbruik van propaanzuur is bestemd voor diervoeder en korrelbehoud, terwijl bijna 29% wordt gebruikt bij de productie van calcium- en natriumpropionatos, die ook worden gebruikt in de voedsel- en voederindustrie.
Kan u van dienst zijn: lithiumhydride: structuur, eigenschappen, verkrijgen, gebruik- Andere belangrijke markten voor propaanzuur zijn herbicideproductie en die van Cetona Diethyl. Lagere volumetoepassingen omvatten celluloseacetaatpropionaat, farmaceutische producten, oplosmiddelen, aromatisering en geur, kunststof, kleurstoffen en textiel, leerleren en rubberassistenten.
- De vraag naar propaanzuur hangt grotendeels af van de productie van voeder en granen, gevolgd door verpakte voedingsmiddelen en bakkerijproducten.
- Andere snelgroeiende markten omvatten propionaatesters voor oplosmiddelen, zoals N-Butilo en Pentilo Propionate. Deze esters worden in toenemende mate gebruikt als vervangers voor oplosmiddelen die worden vermeld als gevaarlijke luchtverontreinigende stoffen.
Referenties
- Propionzuur. Hersteld van EBI.AC.Uk.
- Propionzuur. HMDB hersteld.AC.
- Handboekzuur voor chemische economie Handboekzuur. Opgehaald uit IHS IHS.com.

