Píchric Acid Wat is, structuur, synthese, eigenschappen
- 4154
- 1254
- Alton D'Amore
Hij Peilzuur Het is een zeer nitrado organische chemische verbinding waarvan de naam IUPAC 2,4,6-trinitrofenol is. De moleculaire formule is c6H2(NEE2))3Oh. Het is een zeer zure fenol en kan worden gevonden als natriumpicraat, ammonium of kalium; dat wil zeggen, in zijn ionische vorm c6H2(NEE2))3OP EEN.
Het is een vaste stof van een sterke smaak van bitter en ontleent zijn naam, uit het Griekse woord 'Prikos', wat bitter betekent. Het wordt gevonden als natte gele kristallen. De uitdroging of uitdroging is gevaarlijk, omdat het de onstabiele eigenschappen verhoogt die het explosief maken.
Píchriczuur wordt gebruikt als basis voor de synthese van permanente gele tonenkleurstoffen. Sommige pathologen en onderzoekers gebruiken het in de fixatie of kleuring van weefselsecties en andere immunohistochemische processen.
Het is erg handig bij de ontwikkeling van farmaceutische producten. Bovendien wordt het gebruikt bij de uitwerking van wedstrijden of wedstrijden en explosieven. Het wordt ook gebruikt om metalen op te nemen, om gekleurd glas te maken, en in de colorimetrische bepaling van biologische parameters zoals creatinine.
Structuur
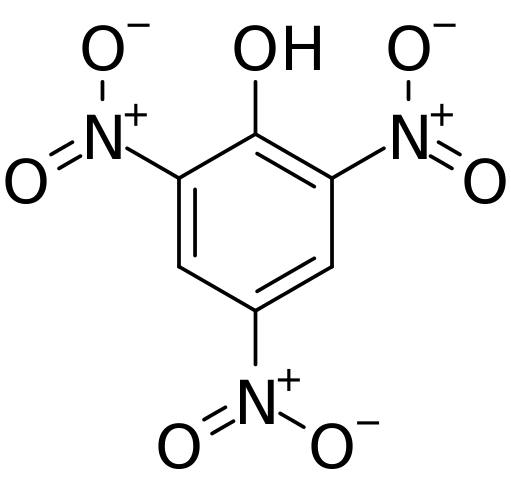
 Structuur en formele belastingen in pychorinezuur. Bron: CVF-PS [Public Domain]
Structuur en formele belastingen in pychorinezuur. Bron: CVF-PS [Public Domain] In het bovenste beeld worden alle bindingen en de structuur in zichzelf van het píchriczuurmolecuul in meer detail getoond. Het bestaat uit een fenol met drie nitro -substituenten.
Het is te zien dat in groepen niet2 Het stikstofatoom heeft een positieve gedeeltelijke belasting en is daarom de vraag naar elektronische dichtheid uit zijn omgeving. Maar de aromatische ring trekt ook de elektronen naar zich toe, en voor de drie nee2 Wordt uiteindelijk een deel van zijn eigen elektronische dichtheid.
Als gevolg hiervan heeft de OH -groep zuurstof meer de neiging om een van zijn vrije elektronische collega's te delen om de elektronische deficiëntie te leveren die de ring leed; En daarbij wordt de link C = O gevormd+-H. Deze positieve gedeeltelijke belasting in zuurstof verzwakt de O-H-binding en de zuurgraad neemt toe; dat wil zeggen, het zal worden vrijgegeven als waterstofionen, h+.
Zure fenol
Het is om deze reden dat deze verbinding een uitzonderlijk sterk zuur (en reagens) is, zelfs meer dan azijnzuur zelf. De verbinding is echter echt een fenol waarvan de zuurgraad die van de andere fenolen overtreft; Dankzij, zoals zojuist is vermeld, de substituenten niet2.
Kan u van dienst zijn: thermodynamische processenOmdat het een fenol is, heeft de OH -groep daarom prioriteit en stuurt de opsomming in de structuur. De drie nee2 Ze bevinden zich in koolstofatomen 2, 4 en 6 van de aromatische ring ten opzichte van OH. Vanaf hier ontleent de IUPAC-nomenclatuur voor deze verbinding: 2,4,6-trinitrofenol (TNP).
Als de groepen dat niet waren2, Of als er een kleiner aantal in de ring was, zou de O-H-link minder verzwakken, en daarom zou de verbinding minder zuurgraad hebben.
Kristallijne structuur
Pycrinezuurmoleculen worden zo geordend dat ze de voorkeur geven aan hun intermoleculaire interacties; hetzij voor de vorming van waterstofbruggen tussen OH -groepen en niet2, Dipolo-Dipolo-krachten, of elektrostatische afstotingen tussen de slechte elektronengebieden.
Men kan worden verwacht dat groepen dat niet doen2 Ze afstoten elkaar en begeleiding in de richting van aangrenzende aromatische ringen. Evenzo konden de ringen één niet bovenop elkaar uitlijnen vanwege een toename van elektrostatische afstotingen.
Als gevolg van al deze interacties slaagt Píchric Acid erin een drie -dimensionaal netwerk te vormen dat een kristal definieert; waarvan de eenheidscel overeenkomt met een kristallijn systeem van het ortorrombische type.
Synthese
Aanvankelijk werd het gesynthetiseerd uit natuurlijke verbindingen zoals dierenhoornderivaten, natuurlijke harsen, onder anderen. Vanaf 1841 is fenol gebruikt als een voorloper van het picrinezuur, na verschillende routes of via verschillende chemische procedures.
Zoals reeds gezegd, is het een van de meest zure fenolen. Om het te synthetiseren is eerst vereist dat het fenol een sulfonatieproces lijdt, gevolgd door een nitratieprocedure.
De sulfonatie van het watervrije fenol wordt uitgevoerd bij het behandelen van het fenol met rookzwavelzuur, dat aromatische elektrofylische substituties van H door sulfonaatgroepen, dus3H, in de positie -orto en -para met betrekking tot de OH -groep.
Dit product, 2,4-pynoldisulfonzuur, het nitratieproces wordt uitgevoerd, en behandelt het met geconcentreerd salpeterzuur. Daarbij zijn de twee so -groepen3H worden vervangen door nitro -groepen, nee2, En een derde komt de andere nitropositie binnen. De volgende chemische vergelijking illustreert dit:
Kan u van dienst zijn: elastische materialen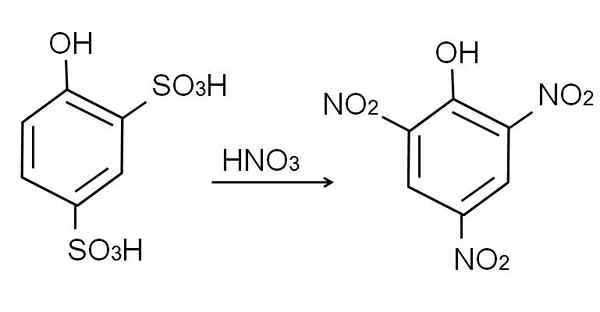 Zure nitratie 2,4-fenoldisulfonic. Bron: Gabriel Bolívar.
Zure nitratie 2,4-fenoldisulfonic. Bron: Gabriel Bolívar. Directe nitratie van de fenol
Het nitratieproces van het fenol kan niet direct worden uitgevoerd, omdat doelen met een hoog molecuulgewicht worden gegenereerd. Deze synthesemethode heeft een zeer zorgvuldige controle van de temperatuur nodig, omdat deze erg exotherme is:
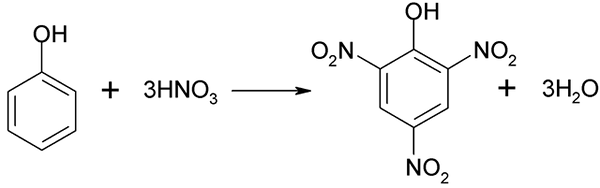 Directe nitratie van de fenol. Bron: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Directe nitratie van de fenol. Bron: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Píchriczuur kan worden verkregen bij het uitvoeren van het directe nitratieproces van 2,4-dinitrofenol, met salpeterzuur.
Een andere vorm van synthese is het behandelen van benzeen met salpeterzuur en kwiknitraat.
Fysische en chemische eigenschappen
Molecuulgewicht
229.104 g/mol.
Fysiek uiterlijk
Gele massa natte kristallen.
Geur
Het is toilet.
Smaak
Het is erg bitter.
Smeltpunt
122.5 ° C.
Kookpunt
300 ° C. Maar tijdens het smelten explodeert het.
Dikte
1.77 g/ml.
Oplosbaarheid
Het is een matig in water oplosbare verbinding. Dit komt omdat je OH -groepen en niet2 Ze kunnen interageren met watermoleculen door waterstofbruggen; Hoewel de aromatische ring hydrofoob is, en daarom schaadt het zijn oplosbaarheid.
Corrosiviteit
Pycrinezuur is in het algemeen corrosief voor metalen, behalve voor tin en aluminium.
Pka
0,38. Het is een sterk organisch zuur.
Instabiliteit
Píchriczuur wordt gekenmerkt door onstabiele eigenschappen te bezitten. Het vormt een risico voor het milieu, het is onstabiel, explosief en giftig.
Het moet goed worden opgeslagen om uitdroging te voorkomen, omdat het picrinezuur erg explosief is als het mag drogen. Je moet heel voorzichtig zijn met zijn watervrije vorm, omdat het erg gevoelig is voor wrijving, slagen en warmte.
Pychralzuur moet worden bewaard in geventileerde, verse plaatsen, verre van oxideerbare materialen. Het is irritant om contact op te nemen met de huid en slijmvliezen, het mag niet worden ingenomen en het is giftig voor het lichaam.
Toepassingen
Píchriczuur wordt veel gebruikt in het onderzoeksgebied, in de chemie, in de industrie en in het militaire veld.
Onderzoek
Wanneer het wordt gebruikt als cel- en weefselfixeermiddel, verbetert het de kleurresultaten van hun met zure kleurstoffen. Het gebeurt met trichromische kleurmethoden. Nadat het weefsel met formaline heeft ingesteld, wordt een nieuwe fixatie met píchriczuur aanbevolen.
Kan u van dienst zijn: Druk op Filter: kenmerken, onderdelen, hoe het werkt, gebruiktOp deze manier is een intense en zeer heldere kleuring van de weefsels gegarandeerd. Goede resultaten worden verkregen met basiskleurstoffen. Voorzorgsmaatregelen moeten echter.
Organische chemie
-In organische chemie wordt het gebruikt als alkalische picrates om identificatie en analyse van verschillende stoffen te maken.
-Wordt gebruikt in metaalanalytische chemie.
-In klinische laboratoria wordt het gebruikt bij het bepalen van het serum- en urinegehalte van creatinine.
-Het is ook gebruikt in sommige van de reagentia die worden gebruikt voor de analyse van glucosewaarden.
In de industrie
-Op het niveau van de fotografische industrie is píchriczuur gebruikt als sensibilisator in fotografische emulsies. Maakt deel uit van de uitwerking van producten zoals pesticiden, sterke insecticiden, onder andere.
-Píchriczuur wordt gebruikt om andere tussenliggende chemische verbindingen zoals chloropicrine en picramisch zuur te synthetiseren, bijvoorbeeld. Uit deze verbindingen zijn sommige medicijnen en kleurstoffen voor de leerindustrie ontwikkeld.
-Píchriczuur werd gebruikt bij de behandeling van brandwonden, zoals antisepticum en andere aandoeningen, voordat de toxiciteit ervan werd aangetoond.
-Belangrijke component door zijn explosieve aard in de uitwerking van wedstrijden en batterijen.
Militaire toepassingen
-Vanwege de hoge explosiviteit van píchriczuur is het gebruikt in militaire wapenmunitiefabrieken.
-Píchriczuur gedrukt en gegoten in artillerieprojectielen, pompen en mijnen is gebruikt.
-Pycrinezuur ammoniumzout is gebruikt als explosief, is zeer krachtig maar minder stabiliteit dan TNT. Een tijd lang werd het gebruikt als een raketbrandstofcomponent.
Toxiciteit
Het is bewezen dat het zeer giftig is voor het menselijk organisme en in het algemeen voor alle levende wezens.
Het wordt aanbevolen om de inademing en inname ervan te voorkomen, voor acute orale toxiciteit. Het veroorzaakt ook mutatie in micro -organismen. Het presenteert toxische effecten op dieren in het wild, bij zoogdieren en in het algemeen in de omgeving.
Referenties
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Purdue universiteit. (2004). Picriczuur explosie. Opgehaald uit: Chemed.Chem.Purdue.Edu
- « Patricia Benner Biography, Theory en andere bijdragen
- Maguey wat is, kenmerken, habitat, reproductie »

