Fluorhorinezuur (HF)
- 3464
- 1059
- Lonnie Rohan
Wat is fluorhorzuur?
Hij hydrofluorinezuur (HF)Het is een waterige oplossing waarin waterstoffluoride wordt opgelost. Dit zuur wordt voornamelijk verkregen uit de reactie van zwavelzuur geconcentreerd met fluorietmineraal (CAF2)). Het mineraal wordt afgebroken door de werking van het resterende zuur en water lost de waterstoffluoridegassen op.
Van hetzelfde zure water kan het zuivere product worden gedestilleerd, dat wil zeggen anhydride waterstoffluoride. Afhankelijk van de hoeveelheden opgelost gas, worden verschillende concentraties verkregen en daarom verschillende beschikbare producten van fluorhorhorinezuur in de markt.
Bij een concentratie van minder dan 40 %heeft het een niet te onderscheiden kristallijn uiterlijk van water, maar bij hogere concentraties staat afscheid van witte waterstoffluoridedampen. Fluorhorinezuur staat bekend als een van de meest agressieve en gevaarlijke chemicaliën.
Het is in staat om bijna elk materiaal te "eten" waarmee u contact hebt: van glas, keramiek en metalen tot rotsen en beton. Waarin container wordt opgeslagen? In plastic flessen, inerte synthetische polymeren voor uw actie.
Formule
De waterstoffluoride -formule is HF, maar die van fluorhorinezuur wordt weergegeven in een waterig medium, HF (AC), om zich te onderscheiden van de eerste.
Fluorhorinezuur kan dus worden beschouwd als hydraatwaterstoffluoride, en dit is anhydride.
Structuur van hydrofluorinezuur
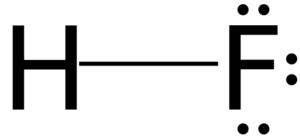 3D -model van fluorhydrinezuur
3D -model van fluorhydrinezuur Al het zuur in water heeft het vermogen om ionen te genereren in een evenwichtsreactie. In het geval van fluoridezuur wordt geschat dat er in een oplossing het paar hones h is h3OF+ en f-.
Anion f- Vorm waarschijnlijk een zeer sterke waterstofbrug met een van de kationhydrogenen (F-H-O+-H2)). Dit verklaart waarom fluorhorinezuur een zwak breezuur is (protonen donor, h+), ondanks zijn hoge en gevaarlijke reactiviteit; dat wil zeggen, in water geeft niet zoveel h vrij+ Vergeleken met andere zuren (HCl, HBR of HI).
Het kan u van dienst zijn: hoeveel Custain -elektronen heeft koolstof?In geconcentreerde fluorhorinezuur interacties tussen waterstoffluoridemoleculen zijn echter effectief genoeg om te kunnen ontsnappen in een gasfase.
Dat wil zeggen, in het water kunnen ze interageren alsof ze zich in het vloeibare anhydride bevinden, waardoor waterstofbruggen tussen deze worden gevormd. Deze waterstofbruggen kunnen worden geassimileerd als bijna lineaire ketens (H-F-H-F-H-F- ...) omgeven door water.
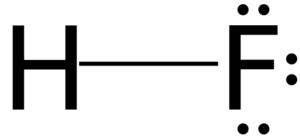
In het superieure beeld werkt het niet-gescheiden koppel van elektronen georiënteerd in de tegenovergestelde richting van de link (H-F :) interageert met een ander HF-molecuul om de ketting te assembleren.
Eigenschappen van hydrofluorinezuur
Omdat het fluorhorinezuur een waterige oplossing is, zijn de eigenschappen ervan afhankelijk van de concentratie van anhydride opgelost in water. De HF is zeer oplosbaar in water en is hygroscopisch, in staat zijn om een verscheidenheid aan oplossingen te produceren: van zeer geconcentreerd (roken en met gele tinten) tot zeer verdund.
Naarmate de concentratie ervan afneemt, neemt HF (AC) eigenschappen meer gelijk aan zuiver water dan anhydride. H-F-H waterstofbruggen zijn echter sterker dan die in water, h2OH OH.
Beide bestaan samen in harmonie in oplossingen, waardoor kookpunten worden verhoogd (tot 105 ° C). Evenzo nemen de dichtheden toe naarmate meer hinhydrid wordt opgelost. Van de rest hebben alle HF (AC) oplossingen sterke en irritante geuren en zijn ze kleurloos.
Reactiviteit
Dus wat is het corrosieve gedrag van fluorhorinezuur? Het antwoord bevindt zich in de H-F-link en in het vermogen van het fluoratoom van het vormen van zeer stabiele covalente links.
Omdat fluoride een zeer klein en elektronegatief atoom is, is het een krachtig Lewis -zuur. Dat wil zeggen, het scheidt van waterstof om soorten te verbinden die meer elektronen aanbieden aan een lage energiekosten. Deze soorten kunnen bijvoorbeeld metalen zijn, zoals het silicium in het glas.
Het kan u van dienst zijn: Nucleaire chemie: geschiedenis, studiegebied, gebieden, toepassingenSIO2 + 4 HF → SIF4(g) + 2 H2OF
SIO2 + 6 HF → H2Sif6 + 2 H2OF
Als de dissociatie-energie van de H-F-link hoog is (574 kJ/mol), waarom is deze dan gebroken in reacties? Het antwoord heeft kinetische, structurele en energie -nuances. Over het algemeen, hoe minder reactief het resulterende product, hoe meer de voorkeur zijn vorming is.
Wat gebeurt er met f- in water? In geconcentreerde oplossingen van fluorhorisch zuur kan een ander HF -molecuul een waterstofbrug vormen met de F- van het paar [h3OF+F-].
Dit resulteert in het genereren van het defluoride -ion [FHF]-, die buitengewoon zuur is. Daarom is al het fysieke contact hiermee uiterst schadelijk. De minste blootstelling kan een oneindigheid van schade aan het agentschap veroorzaken.
Er zijn veel veiligheidsnormen en protocollen voor adequaat beheer, en vermijden dus potentiële ongevallen voor degenen die met dit zuur werken.
Gebruikt/toepassingen van fluorhorinezuur
Het is een verbinding met tal van toepassingen in de branche, in onderzoek en in het werk van consumenten:
- Fluorhorinezuur genereert organische derivaten die betrokken zijn bij het aluminiumzuiveringsproces.
- Het wordt gebruikt bij de scheiding van uraniumisotopen, zoals in het geval van uranium hexafluoruro (uf6)). Het wordt ook gebruikt bij de extractie, verwerking en raffinage van metalen, rotsen en oliën, die ook worden gebruikt voor de remming van schimmelgroei en verwijdering van de schimmel.
- Corrosieve zuureigenschappen zijn gebruikt om kristallen te snijden en op te nemen, vooral ijzige, door de techniek van etsen.
- Het wordt gebruikt bij de productie van siliconen halfgeleiders, met meerdere toepassingen bij de ontwikkeling van computergebruik en informatica, verantwoordelijk voor de ontwikkeling van de mens.
- Het wordt in de auto -industrie gebruikt als schoner, gebruikt als een schimmelverwijderaar in keramiek.
- Naast het dienen als intermediair in sommige chemische reacties, wordt fluorhorzuur gebruikt bij sommige ionenwisselaars die betrokken zijn bij de zuivering van meer complexe metalen en stoffen.
- Deelnemen aan olieverwerking en zijn derivaten, waardoor het verkrijgen van oplosmiddelen voor gebruik bij de productie van producten voor het reinigen en elimineren van vetten mogelijk is.
- Het wordt gebruikt bij het genereren van middelen voor het fineer- en oppervlaktebehandeling.
- Consumenten gebruiken talloze producten waarin fluorhorzuur heeft deelgenomen aan de uitwerking; Sommige zijn bijvoorbeeld nodig voor autoverzorging, schoonmaakproducten voor meubels, elektrische en elektronische componenten en brandstoffen, onder andere producten.
Referenties
- Pubchem. (2018). Hydrofluorinezuur. Ontvangen op 3 april 2018, van: PubChem.NCBI.NLM.NIH.Gov.
- Kat -dag. (16 april 2013). Het zuur dat echt alles doortelt. Ontvangen op 3 april 2018, van: Chronicleflask.com
- Wikipedia. (28 maart 2018). Hydrofluorinezuur. Ontvangen op 3 april 2018, van: In.Wikipedia.borg.
- Shiver & Atkins. (2008). Anorganische scheikunde. (vierde druk., P. 129, 207-249, 349, 407). MC Graw Hill.
- Hydrofluorinezuur. MUSC. Medische Universiteit van South Carolina. Ontvangen op 3 april 2018, van: AcademicDepartments.MUSC.Edu