Wat is disulfuric wat is, structuur, eigenschappen, gebruik
- 3400
- 90
- Alton D'Amore
Wat is disulfurinezuur?
Hij disulfurinezuur Het is een van de vele zwaveloxoacides, wiens chemische formule H is2S2OF7. De formule geeft expliciet aan dat er twee zwavelatomen zijn, en zoals de naam ook aangeeft, moeten er twee H -moleculen zijn2SW4 maar een; Er zijn echter zeven zuurstof in plaats van acht, dus een zwavel moet er drie hebben.
Dit zuur is als een van de belangrijkste componenten van de olie (of rook zwavelzuur), die een "dichte" vorm van zwavelzuur wordt. Dat is hun overheersing, die sommigen olie beschouwen als een synoniem voor disulfurinezuur; die ook bekend is onder de traditionele naam van pyrosulfurinezuur.
In het beeld wordt een ontvanger met olie getoond, met een concentratie zwaveltrioxide, dus3, 20 %. Deze stof wordt gekenmerkt door vettig en kleurloos te zijn; Hoewel geelachtig of bruin geel kan worden, afhankelijk van de concentratie van de SO3 en van de aanwezigheid van enkele onzuiverheden.
Het bovenstaande vertelt de deelname van de SO3 in h2S2OF7; dat wil zeggen een H -molecuul2SW4 Reageren met een van So3 Om disulfurinezuur te vormen. Zijn dan, h2S2OF7 Het kan ook worden geschreven als h2SW4· SW3.
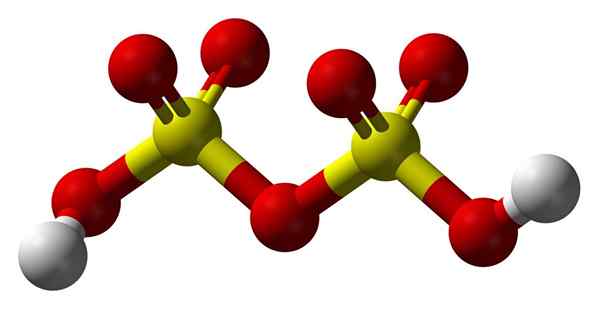
Disulfurinezuurstructuur
 Disulfurinezuurstructuur
Disulfurinezuurstructuur Omhoog2S2OF7 In een sferen en barsmodel. Let op de symmetrie van het molecuul: de linkerkant van de zuurstofbrug is identiek aan de rechterkant. Vanuit dat perspectief kan de structuur worden beschreven met de HO -formule3Flauw3H.
Aan beide uiteinden zijn elke hydroxylgroep, waarvan de waterstof, door het inductieve effect van al die zuurstofatomen, zijn positieve gedeeltelijke belasting verhoogt; En bijgevolg heeft disulfurinezuur nog een sterkere zuurgraad dan zwavelzuur.
Kan u van dienst zijn: kaliumhydroxide: structuur, eigenschappen, gebruikHet molecuul kan worden geschreven als h2SW4· SW3. Dit verwijst echter meer naar een samenstelling van het oleum dan naar de structuur van een molecuul.
Als er echter een watermolecuul wordt toegevoegd aan H2S2OF7, Twee H -moleculen worden vrijgegeven2SW4:
H2S2OF7 + H2Of 2H2SW4
De balans kan naar links gaan: naar de vorming van h2S2OF7 Van h2SW4 Als warmte wordt geleverd. Het is om deze reden dat h2S2OF7 Het is ook bekend als pyrosulfurinezuur; Omdat het kan worden gegenereerd na het verwarmen van zwavelzuur.
Ook, zoals in het begin vermeld, h2S2OF7 Het wordt gevormd door de directe combinatie van h2SW4 En dus3:
SW3 + H2SW4 H2S2OF7
Eigenschappen
 Oleum. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)], via Wikimedia Commons
Oleum. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)], via Wikimedia Commons De eigenschappen van disulfurinezuur zijn niet erg goed gedefinieerd, omdat het uiterst moeilijk is om puur uit de olie te worden geïsoleerd.
Er moet aan worden herinnerd dat er andere verbindingen in de olie kunnen zijn, met H H2SW4· XSO3, Waar afhankelijk van de waarde van X zelfs polymere structuren kan hebben.
Een manier om het te visualiseren is om je voor te stellen dat de bovenste structuur van h2S2OF7 wordt meer langwerpig door meer eenheden van SO3 en zuurstofbruggen.
In een bijna pure toestand bestaat het uit een onstabiele kristallijne vaste stof (roken) die smelt bij 36 ° C. Dit smeltpunt kan echter variëren, afhankelijk van de echte compositie.
Disulfurinezuur kan vormen wat bekend staat als disulfaten (of pyrosulfaat) zouten. Als u bijvoorbeeld reageert met kaliumhydroxide, vormt u kaliumpyrosulfaat, k2S2OF7.
Bovendien kan worden opgemerkt dat het een molecuulgewicht heeft van 178 g/mol en twee zuur equivalent (2 uur ionen+ die kan worden geneutraliseerd met een sterke basis).
Kan u van dienst zijn: vervluchtigingSuikeruitdratingsreactie
Met deze olie -vormige verbinding kan een nieuwsgierige reactie worden uitgevoerd: de transformatie van koolstofblokken.
De H2S2OF7 Het reageert met suikers die al zijn OH -groepen elimineren in de vorm van water, die nieuwe vakbonden bevorderen tussen koolstofatomen; vakbonden die uiteindelijk zwarte steenkool veroorzaken.
Nomenclatuur
Disulfurinezuur wordt beschouwd als het anhydride van zwavelzuur; Dat wil zeggen, het verliest een watermolecuulproduct van condensatie tussen twee zure moleculen. Vóór zoveel mogelijke namen voor deze verbinding beveelt de IUPAC -nomenclatuur gewoon aan die van disulfurinezuur.
De term 'Piro' verwijst exclusief naar die gevormd als een product van warmte -toepassing. IUPAC adviseert deze naam niet voor h2S2OF7; Maar het wordt momenteel nog steeds gebruikt door veel chemici.
De beëindiging -ico blijft onveranderlijk omdat het zwavelatoom een valentie van +6 blijft behouden. Het kan bijvoorbeeld worden berekend door de volgende rekenkundige bewerking:
2H + 2S + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Toepassingen
Zwavelzuur opslaan
Disulfurinezuur, gezien zijn eigenschap om als olie te stollen, is in staat om veiliger zwavelzuur op te lossen en op te slaan. Dit komt omdat de SO3 ontsnapt aan het creëren van een onwrikbare "mist", die veel oplosbaarder is in h2SW4 dan in water. Om h te verkrijgen2SW4, Het zou voldoende zijn om toe te voegen aan de waterolie:
H2S2OF7 + H2Of 2H2SW4
100% zwavelzuursynthese
Van de vorige vergelijking, h2SW4 Het wordt verdund in het toegevoegde water. Als u bijvoorbeeld een waterige oplossing van h heeft2SW4, Waar de So3 Het heeft de neiging om te ontsnappen en vormt een risico voor werknemers, waardoor olie wordt toegevoegd aan oplossing dit reageert met water dat meer zwavelzuur vormt; dat wil zeggen, het verhogen van zijn concentratie.
Het kan u van dienst zijn: chemische ondoordringbaarheidAls er nog water over is, wordt er meer toegevoegd3, die reageert met h2SW4 Om meer disulfuriczuur of olie te produceren, en dan hydrateert het opnieuw de h "drogen"2SW4. Het proces herhaalt het soms genoeg om zwavelzuur te verkrijgen met een concentratie van 100%.
Een soortgelijk proces wordt gebruikt om 100% salpeterzuur te verkrijgen. Evenzo is het gebruikt om andere chemische stoffen uit te drogen, gebruikt voor explosieve uitwerking.
Sulfonatie
Structuren, zoals kleurstoffen; dat wil zeggen, groepen toevoegen -zo3H, dat het verliezen van uw zure proton kan worden verankerd aan het textielvezelpolymeer.
Aan de andere kant wordt de zuurgraad van het oleum gebruikt om de tweede nitratie te bereiken (groepen toevoegen -Nee2) naar de aromatische ringen.
Referenties
- Anorganische scheikunde. (vierde druk). MC Graw Hill.
- Pyrosulfuriczuur. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- « 20 uitvindingen van de renaissance die de wereld hebben veranderd
- Bacterieel uitstrijkje wat is, kenmerken en voorbereiding »

