Moleculaire structuur cyanhydrinezuur, eigenschappen, gebruik

- 722
- 54
- Hugo Crooks
Hij hydrocyaninezuur o Waterstofcyanide is een organische verbinding waarvan de chemische formule HCN is. Het is ook bekend als metanonitril.
Cyanhydrinezuur is een kleurloos, extreem giftig gas, dat wordt verkregen bij het behandelen van cyaniden met zuren. Dit zuur bevindt zich in het Peaplied Seed, ook op veel plaatsen bekend als een perzik.
 Perzikzaad, dat waterstofcyanide of waterstofcyanide, HCN bevat. Een.HA [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons.
Perzikzaad, dat waterstofcyanide of waterstofcyanide, HCN bevat. Een.HA [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons. Bij een omgevingstemperatuur is minder dan 25 ºC een vloeistof en boven die temperatuur is een gas. In beide gevallen is het uiterst giftig voor de mens, dieren en zelfs de meerderheid van de micro -organismen die er niet aan worden geacclimatiseerd. Het is een goed oplosmiddel voor ionen. Het is erg onstabiel omdat het de neiging heeft om gemakkelijk te polymeriseren.
Het wordt gevonden in het groentekoninkrijk opgenomen in de moleculen van sommige glucosiden, omdat wanneer ze worden gehydrolyseerd door enzymen van de groente, de HCN, Glucose en Benzaldehyde worden verkregen.
Deze glucosiden bevinden zich in de zaden van bepaalde fruit zoals perziken, abrikoos, kersen, pruimen en in bittere amandelen, dus ze mogen nooit worden ingenomen.
Het wordt ook gevonden in planten zoals sommige soorten sorghum. Bovendien produceren sommige bacteriën het tijdens hun metabolisme. Het wordt meestal gebruikt in de productie van polymeren en in sommige metallurgische processen.
HCN is een dodelijk gif door inademing, inname en contact. Het is aanwezig in de rook van de sigaret en in de rook van het vuur van kunststoffen en materialen die koolstof en stikstof bevatten. Het wordt beschouwd als een luchtverontreinigende stof die plaatsvindt tijdens de verbranding van organisch materiaal uit uitgebreide delen van de planeet.
[TOC]
Moleculaire structuur en elektronische configuratie
Waterstofcyanide of cyanidezuur is een covalente, moleculaire verbinding, met een waterstofatoom, een koolstof en een van stikstof.
Het koolstof- en stikstofatoom delen 3 paren elektronen, dus ze vormen een drievoudige link. Waterstof is gekoppeld aan koolstof, wat met deze vakbond zijn Valencia de Cuatro en zijn complete elektronenoctet presenteert.
De stikstof presenteert een vijf Valencia van vijf en om zijn octet te voltooien heeft een paar verdwenen of eenzame elektronen die zich lateraal bevinden.
De HCN is daarom een volledig lineair molecuul, met een paar ontbrekende elektronen die zich lateraal in stikstof bevinden.
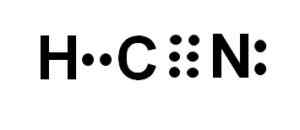 Lewis -weergave van het cyanhydrinezuur, waarbij de elektronen gedeeld in elke binding en het paar eenzame stikstofelektronen worden waargenomen. Auteur: Marilú Stea.
Lewis -weergave van het cyanhydrinezuur, waarbij de elektronen gedeeld in elke binding en het paar eenzame stikstofelektronen worden waargenomen. Auteur: Marilú Stea. 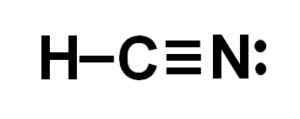 Waterstofcyanide of waterstofcyanide structuur waarbij de drievoudige binding tussen koolstof en stikstof wordt waargenomen. Auteur: Marilú Stea.
Waterstofcyanide of waterstofcyanide structuur waarbij de drievoudige binding tussen koolstof en stikstof wordt waargenomen. Auteur: Marilú Stea. Nomenclatuur
- Hydrocyaninezuur
- Waterstofcyanide
- Metanonitril
- Formonitril
- Hydrocyaninezuur
Eigenschappen
Fysieke staat
Onder 25,6 ºC, als het watervrij is en gestabiliseerd is, is het een zeer onstabiele en giftige lichtblauwe vloeistof of blauw. Als het boven die temperatuur staat, is een extreem giftig kleurloos gas.
Molecuulgewicht
27.03 g/mol
Smeltpunt
-13.28 ºC
Kookpunt
25,63 ºC (merk op dat het net boven de omgevingstemperatuur kookt).
Flitslicht
-18 ºC (methode gesloten beker)
Zelfsturingstemperatuur
538 ºC
Kan u van dienst zijn: gaschromatografieDikte
0,6875 g/cm3 bij 20 ºC
Oplosbaarheid
Helemaal mengbaar met water, ethylalcohol en ethylether.
Dissociatie constant
K = 2,1 x 10-9
Pknaar = 9.2 (het is een zeer zwak zuur)
Enkele chemische eigenschappen
De HCN heeft een zeer hoge diëlektrische constante (107 tot 25 ° C). Dit komt omdat hun moleculen zeer polair zijn en worden geassocieerd door waterstofbruggen, zoals in het geval van water h2OF.
Om zo'n hoge diëlektrische constante te hebben, blijkt HCN een goed ioniserend oplosmiddel te zijn.
De vloeibare watervrij HCN is zeer onstabiel, het heeft de neiging om gewelddadig te polymeriseren. Om dit te voorkomen, worden stabilisatoren toegevoegd als een klein percentage van H2SW4.
In waterige oplossing en in aanwezigheid van ammoniak en hoge druk adeninevorm, verbinding die deel uitmaakt van het DNA en RNA, dat wil zeggen een biologisch belangrijk molecuul.
Het is een zeer zwak zuur, omdat de ionisatieconstante erg klein is, dus het is slechts gedeeltelijk in water dat het cyanide -anion cn geeft-. Vorm zouten met de bases maar niet met carbonaten.
Zijn waterige oplossingen die niet tegen licht worden beschermd, worden langzaam ontleed voor het genereren van ammoniumformiatie hcoonh4.
In oplossing presenteert het een zwakke geur van amandelen.
Corrosiviteit
Omdat het een zwak zuur is, is het over het algemeen niet corrosief.
HCN waterige oplossingen die zwavelzuur bevatten als stabilisator vallen echter sterk staal aan bij temperaturen van meer dan 40 ºC en roestvrij staal bij temperaturen van meer dan 80 ° C.
Bovendien kunnen HCN -verdunde waterige oplossingen koolstofstaal veroorzaken, zelfs bij kamertemperatuur.
Je kunt ook enkele soorten rubber, kunststoffen en coatings aanvallen.
Locatie in de natuur
Het is relatief overvloedig in het plantenrijk dat deel uitmaakt van glucosiden.
Het wordt bijvoorbeeld gegenereerd uit de tonsilin c6H5-CH (-cn) -o-glycose-glycose, verbinding aanwezig in bittere amandelen. De tonsil is een cyanogene bèta-glucoside, want wanneer het gehydrolyseerd is, vormt het twee glucosemoleculen, een van benzaldehyde en een van hcn. Het enzym dat ze vrijgeeft, is beta-glucoxidase.
De amandelen zijn te vinden in de zaden van perziken, abrikoos, bittere amandelen, kersen en pruimen.
Sommige soorten sorghumplanten bevatten de cyanogene glucóside genaamd Durrina (dat wil zeggen de p-hydroxy- (S) -Mandelonitrilo-beta-D-glucoside). Deze verbinding kan worden afgebroken door twee -step enzymatische hydrolyse.
Ten eerste, het durrinosa-enzym dat endogeen is in sorghum planten hydrolys met glucose en p-hydroxy- (S) -Mandelonitrilo. Dan wordt de laatste snel vrij HCN en p-hydroxibenzaldehyde.
 Sorghumplant met een hoog durrina -gehalte. Geen machine-leesbare auteur verstrekt. Pethan veronderstelde (op basis van claims van het auteursrecht). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikipedia Commons.
Sorghumplant met een hoog durrina -gehalte. Geen machine-leesbare auteur verstrekt. Pethan veronderstelde (op basis van claims van het auteursrecht). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikipedia Commons. HCN is verantwoordelijk voor de weerstand van sorghumplanten tegen ongedierte en ziekteverwekkers.
Dit wordt verklaard door het feit dat de Durrina en het Durrinosa -enzym verschillende locaties in deze planten hebben en alleen in contact komen wanneer de weefsels gewond of vernietigd zijn, de HCN vrijgeven en de plant van infecties die door de gewonde partij zouden kunnen doordringen, vrijgeven.
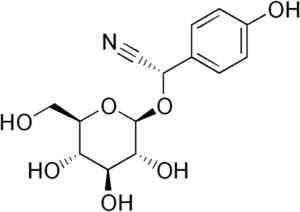 Durrina -molecuul waar de drievoudige CN -binding wordt waargenomen dat door enzymatische hydrolyse hcn produceert. Edgar181 [Public Domain]. Bron: Wikipedia Commons.
Durrina -molecuul waar de drievoudige CN -binding wordt waargenomen dat door enzymatische hydrolyse hcn produceert. Edgar181 [Public Domain]. Bron: Wikipedia Commons. Bovendien zijn sommige pathogene bacteriën van de mens zoals Pseudomonas aeruginosa En P. Gingivalis Ze produceren het tijdens hun metabole activiteit.
Toepassingen
Bij de bereiding van andere chemische en polymerenverbindingen
Het gebruik van de meeste HCN die op industrieel niveau worden geproduceerd, is de voorbereiding van intermediairs voor organische synthese.
Kan u van dienst zijn: ijzeroxide (ii): structuur, nomenclatuur, eigenschappen, gebruikHet wordt gebruikt in adiponitrilesynthese nc- (ch (ch2))4-CN, dat wordt gebruikt om nylon of nylon te bereiden, een polyamide. Het dient ook om Acrilonitrilo of Cianoethyleen Cho voor te bereiden2= CH-CN, gebruikt om acryl- en plastic vezels te bereiden.
Het afgeleide natriumcyanide wordt gebruikt voor het herstel van goud bij de mijnbouw van dit metaal.
Een andere van zijn derivaten CLCN cyanogeenchloride dient voor pesticidenformules.
De HCN wordt gebruikt voor het bereiden van chelerende middelen zoals EDTA (ethylen-diamino-tetra-acetato).
Het dient voor de productie van ferrocyaniden en sommige farmaceutische producten.
Verschillende toepassingen
HCN -gas is gebruikt als een insecticide, fungicide en desinfectiemiddel, voor fumigatie van schip en gebouwen. Ook om meubels te fumigeren om ze te herstellen.
HCN is gebruikt in metalen polish.
Voor zijn zeer hoge toxiciteit werd hij aangesteld als een chemisch oorlogsmiddel.
In de landbouw
Het is gebruikt als herbicide en pesticide in boomgaarden. Hij had gebruikt om schalen en andere pathogenen van citrusbomen te regelen, maar sommige van deze ongedierte zijn resistent geworden tegen HCN.
Het is ook gebruikt om granensilo's te fumigeren. De gasvormige HCN die op de site is bereid, is gebruikt bij de ontsmettingsvermogen van tarwekorrels om ze te behouden tegen ongedierte zoals insecten, schimmels en knaagdieren. Voor dit gebruik is het essentieel dat zaden moeten worden uitgeroeid.
Tests die fumigerende tarwezaden zijn gedaan met HCN en er is gebleken dat het kiempotentieel hiervan geen negatief beïnvloedt, het lijkt er eerder voor te geven.
Hoge doses HCN kunnen echter de lengte van kleine bladeren die uit het zaad ontspruiten aanzienlijk verminderen.
Aan de andere kant, vanwege het feit dat het een krachtige nematicide is en dat sommige sorghumplanten het in hun weefsels bezitten, wordt het potentieel van sorghumplanten onderzocht om te worden gebruikt als biocid groene meststof.
Het gebruik ervan zou dienen om de bodem te verbeteren, onkruid te onderdrukken en ziekten en schade te beheersen die worden veroorzaakt door fytoparasitaire nematoden.
Risico's
Voor de mens is HCN een dodelijk gif op alle routes: inademing, inname en contact.
 Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay.
Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay. Ingeademd kan dodelijk zijn. Naar schatting kan ongeveer 60-70% van de bevolking de geur van bittere HCN-amandelen detecteren wanneer deze in lucht is bij een concentratie van 1-5 ppm.
Maar er is 20% van de bevolking die het nog steeds niet kan detecteren in dodelijke concentraties omdat het genetisch niet in staat is om dit te doen.
Ingenomen is een acute en onmiddellijke actie -gif.
Als uw oplossingen in contact komen met de huid, kan geassocieerd cyanide dodelijk zijn.
De HCN is aanwezig in de sigarettenrook en degene die wordt gegenereerd wanneer kunststoffen die stikstof bevatten worden verbrand.
Dodelijk actiemechanisme binnen het organisme
Het is een chemische stof en is snel giftig, wat vaak leidt tot de dood. Bij het betreden van het organisme sluit het zich aan bij de metalloenzymen (enzymen die een metaalion bevatten) die ze inactiveren. Het is een giftig middel voor verschillende organen van het menselijk lichaam
Het belangrijkste toxische effect bestaat uit de remming van cellulaire ademhaling, omdat het een enzym deactiveert dat fosforylering in mitochondriën beïnvloedt, die onder andere organellen zijn die tussenbeide komen in de ademhalingsfunctie van cellen.
Kan u van dienst zijn: kaliumpermanganaat (kmno4)Sigarettenrookrisico
De HCN is aanwezig in de sigarettenrook.
Hoewel veel mensen het effect kennen van het vergiftigen van de HCN, realiseren maar weinig mensen zich dat ze worden blootgesteld aan hun schadelijke effect door sigarettenrook.
HCN is een van de oorzaken van de remming van verschillende cel ademhalingszymen. De hoeveelheid hcn die aanwezig is in de sigarettenrook heeft een schadelijk effect op het zenuwstelsel.
HCN -niveaus zijn gerapporteerd in sigarettenrook tussen 10 en 400 μg per sigaret voor de rook direct en 0,006 tot 0,27 μg/sigaret voor secundaire inhalatie (passieve roker). HCN produceert toxische effecten vanaf 40 μm.
 Auteur: Alexas Foto's. Bron: Pixabay.
Auteur: Alexas Foto's. Bron: Pixabay. Inhaleren komt snel de bloedbaan binnen, waar hij wordt vrijgelaten in het plasma of bindt aan hemoglobine. Een klein deel converteert naar Tiocianato en wordt uitgescheiden door urine.
HCN -verwarmingsrisico's
Langdurige blootstelling aan de warmte van de vloeibare HCN in gesloten containers kan een gewelddadige en onverwachte breuk hiervan veroorzaken. Het kan 50-60 ºC explosief polymeriseren in aanwezigheid van alkali-sporen en in afwezigheid van remmers.
Aanwezigheid van hcn in vuurrook
De HCN komt vrij tijdens de verbranding van polymeren die stikstof bevatten, zoals wol, zijde, polyacrylonitrilos en nylon, onder andere. Deze materialen zijn aanwezig in onze huizen en op de meeste locaties van menselijke activiteit.
Om deze reden tijdens de branden kan de HCN mogelijk de doodsoorzaak zijn door inademing.
Sfeer verontreinigende stof
HCN is een troposfeer verontreinigende stof. Het is resistent tegen fotólysis en onder de omgevingscondities van de atmosfeer lijdt geen hydrolyse.
OH HYDROXYL RADIALS • Geproduceerd fotochemisch kunnen reageren met de HCN, maar de reactie is erg traag, dus de halfwaardetijd van de HCN in de atmosfeer is 2 jaar.
Wanneer biomassa brandt, vooral MOB, wordt HCN vrijgegeven in de atmosfeer, en ook tijdens industriële activiteiten. Turfverbranding is echter 5 tot 10 keer meer vervuilend dan het verbranden van een ander type biomassa.
Sommige onderzoekers hebben ontdekt dat hoge temperaturen en droogte veroorzaakt door het El Niño -fenomeen in bepaalde gebieden van de planeet verergering.
 Auteur: Steve Buissinne. Bron: Pixabay.
Auteur: Steve Buissinne. Bron: Pixabay. Dit leidt tot een intense brandwond van biomassa in droge stations.
Deze gebeurtenissen zijn de bron van hoge concentraties van HCN in de troposfeer, die uiteindelijk naar de lage stratosfeer worden getransporteerd en nog lang blijven.
Referenties
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Waterstofcyanide. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Gidlow, D. (2017). Waterstofcyanide-een update. Occupational Medicine 2017; 67: 662-663. NCBI hersteld.NLM.NIH.Gov.
- Van Nostrand's wetenschappelijke encyclopedie. (2005). Waterstofcyanide. 9e Opgehaald uit de online bibliotheek.Wiley.com.
- Ren, en.-L. et al. (1996). Effect van waterstofcyanide en carbonylsulfide op de kieming en plumule -kracht van tarwe. Pestisch. Sci. 1996, 47, 1-5. Opgehaald uit de online bibliotheek.Wiley.com.
- Van Nicola, G.R. et al. (2011). Voor eenvoudige analytische methode voor evaluatie van dhurrine -gehalte in cyanogene planten voor hun gebruik in voeder en biofumigatie. J. Agrarisch. Food Chem. 2011, 59, 8065-8069. Hersteld van pubs.ACS.borg.
- Sheese, p.EN. et al. (2017). Een wereldwijde verbetering van waterstofcyanide in de lagere stratosfeer ThroupPout 2016. Geofys. Rundvlees. Lett., 44, 5791-5797. Hersteld van agupubs.Online bibliotheek.Wiley.com.
- Surleva, een.R. en drochioiu, g. (2013). Visualisatie Roken Gevaar: eenvoudige spectrofotometrische bepaling van waterstofcyanide in sigarettenrook en filters. J. Chem. Onderwijzer. 2013, 90, 1654-1657. Hersteld van pubs.ACS.borg.
- Alarie, en. et al. (1990). Rol van waterstofcyanide bij menselijke sterfgevallen in vuur. In brand en polymeren. Hoofdstuk 3. ACS Symposium -serie. Hersteld van pubs.ACS.borg.
- « Chroomzuurstructuur, eigenschappen, het verkrijgen, gebruiken
- 8 experimenten met zeer controversiële mensen »

