Chroomzuurstructuur, eigenschappen, het verkrijgen, gebruiken

- 652
- 69
- Aaron Okuneva
Hij chroomzuur of h2Cro4 Het zuur geassocieerd met chroomoxide (VI) of Cro cromicoxide is theoretisch3. Deze denominatie is te wijten aan het feit dat in de zure waterige oplossingen van het chroomoxide de soort h2Cro4 Het is aanwezig met andere chroomsoorten (VI).
Cromisch oxide3 Het wordt ook wat betreft chroomzuur. De Cro3 Het is een roodachtige of paarse bruine vaste stof die wordt verkregen bij de behandeling van kaliumdichromaatoplossingen K2Cr2OF7 Met zwavelzuur h2SW4.
 Cromic -oxide verplettert3 In een smeltkroes. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons.
Cromic -oxide verplettert3 In een smeltkroes. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons. Waterige chroomoxide -oplossingen ervaren een balans van bepaalde chemische soorten waarvan de concentratie afhankelijk is van de pH van de oplossing. Basic pH overheersen Cromate -ionen Cro42-, Terwijl HCRO -zuurionen overheersen4- en cr dicromato2OF72-. Geschat wordt dat zuurzuur ook chroomzuur h is aanwezig2Cro4.
Vanwege het grote oxiderende vermogen worden chroomzuuroplossingen gebruikt in organische chemie om oxidatiereacties uit te voeren. Ze worden ook gebruikt in elektrochemische processen om metalen te behandelen, zodat ze weerstand tegen corrosie en slijtage krijgen.
Bepaalde polymere materialen worden ook behandeld met chroomzuur om hun hechting aan metalen, schilderijen en andere stoffen te verbeteren.
Chroomzuuroplossingen zijn zeer gevaarlijk voor zowel mensen als de meeste dieren en de omgeving. Om deze reden worden de vloeistof- of vaste processen afval waar chroomzuur wordt gebruikt, behandeld om chroom (VI) te elimineren of om alle aanwezige chroom te herstellen en het chroomzuur te regenereren om het opnieuw te gebruiken.
[TOC]
Structuur
Het chroomzuurmolecuul h2Cro4 Het wordt gevormd door een cromato -cro -ion42- en twee waterstofionen h+ Hiertoe verenigd. In het chromaation bevindt het chroomelement zich in een +6 oxidatietoestand.
De ruimtelijke structuur van het chromaation is tetraëdrisch, waarbij chroom zich in het midden bevindt en zuurstof de vier hoekpunten van de tetraëder bezetten.
In chroomzuur zijn waterstofatomen elk naast een zuurstof. Van de vier chroombindingen met de zuurstofatomen zijn er twee dubbel en twee zijn eenvoudig, omdat ze de hydrogenen hebben verenigd.
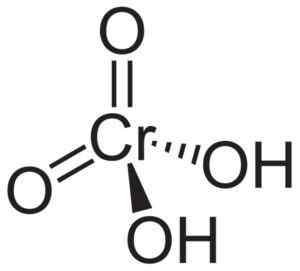 Chroomzuurstructuur h2Cro4 waar de tetraëdrische vorm van chromaat en de dubbele bindingen worden waargenomen. Neuroteker [Public Domain]. Bron: Wikipedia Commons.
Chroomzuurstructuur h2Cro4 waar de tetraëdrische vorm van chromaat en de dubbele bindingen worden waargenomen. Neuroteker [Public Domain]. Bron: Wikipedia Commons. Aan de andere kant, cro -croom -oxide3 Het heeft een oxidatie chroom atoom +6 omgeven door slechts drie zuurstofatomen.
Nomenclatuur
- Kroomzuur H2Cro4
- Tetraoxochrominezuur h2Cro4
- Cromicoxide (watervrij chrominezuur) cro3
- Chroomtrioxide (watervrij chrominezuur) cro3
Eigenschappen
Fysieke staat
Anhydro of chroomoxide chroomzuur is een kristallijne vaste stof van paars tot rood
Molecuulgewicht
Cro3: 118.01 g/mol
Smeltpunt
Cro3: 196 ºC
Boven het smeltpunt is thermisch onstabiel, verliest het zuurstof (het is gereduceerd) om chroomoxide (iii) cr te geven2OF3. Het ontleedt op ongeveer 250 ºC.
Dikte
Cro3: 1.67-2,82 g/cm3
Oplosbaarheid
De Cro3 Het is erg oplosbaar in water: 169 g/100 g water bij 25 ºC.
Het is oplosbaar in minerale zuren zoals zwavel- en salpeter-. Oplosbaar alcohol.
Andere eigenschappen
De Cro3 Het is erg hygroscopisch, de kristallen zijn heerlijk.
Wanneer de CRO3 Het lost op in watervormen sterk zure oplossingen.
Kan u dienen: Titanium: geschiedenis, structuur, eigenschappen, reacties, gebruikHet is een zeer krachtig oxidatiemiddel. Oxy krachtig organisch materiaal in bijna al zijn vormen. Valt de stof, leer en wat kunststoffen aan. De meeste metalen vallen ook aan.
Het is sterk giftig en zeer irriterend vanwege het hoge oxiderende potentieel.
Chemie van waterige oplossingen waar chroomzuur aanwezig is
Cromisch oxide3 Het lost snel op in water. In waterige oplossing kan chroom (VI) bestaan in verschillende ionische vormen.
Een pH> 6,5 of in alkalische oplossing Chrome (VI) verwerft de cromato -ionenvorm42- geel.
Als de pH wordt verlaagd (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , die kunnen dimeriseren tot ion dicromato cr2OF72-, En de oplossing wordt oranje. Bij pH tussen 2,5 en 5,5 zijn de overheersende soorten hcro4- en Cr2OF72-.
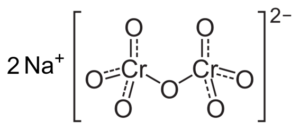 Cr dicromate ionstructuur2OF72- die naast twee natriumnaferen is+. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons.
Cr dicromate ionstructuur2OF72- die naast twee natriumnaferen is+. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons. De saldi die zich voordoen in deze oplossingen wanneer de pH daalt, zijn de volgende:
Cro42- (chromate ion) + h+ ⇔ Hcro4-
Hcro4- + H+ ⇔ H2Cro4 (chroomzuur)
2hcro4- ⇔ Cr2OF72- (Dicromate ion) + h2OF
Deze saldi komen alleen op als het zuur dat wordt toegevoegd om te lager zijn, de pH is3 of HCLO4, Omdat met andere zuren verschillende verbindingen worden gevormd.
De zure oplossingen van dichromaat zijn zeer energetische oxiderende middelen. Maar in alkalische oplossingen is het chromaation veel minder oxidatiemiddel.
Het verkrijgen van
Volgens de geraadpleegde bronnen, een van de manieren om het Cro Cromic -oxide te verkrijgen3, Dit bestaat uit het toevoegen van zwavelzuur aan een waterige oplossing van natrium- of kaliumdichromaat, waardoor een rood-oranje neerslag wordt gevormd.
 Cromicoxide gehydrateerd of chroomzuur. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons.
Cromicoxide gehydrateerd of chroomzuur. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons. Kroomzuur H2Cro4 Het wordt gevonden in waterige chroomoxide -oplossingen in zuur medium.
Chroomzuur gebruik
In de oxidatie van chemische verbindingen
Vanwege de sterk oxiderende capaciteit wordt chroomzuur al lang en met succes gebruikt om organische en anorganische verbindingen te oxideren.
Onder ontelbare voorbeelden zijn de volgende: het maakt het mogelijk om te oxideren van primaire alcoholen voor aldehydo's en deze voor carbonzuren, alcoholen secundair aan ketonen, tolueen tot benzoëzuur, ethylbenzeen tot acetofenon, trifenylmetano tot trifenylcarbinol, formaatzuur a co -co -co -co -co -co -co2, oxaalzuur naar CO2, melkzuur tot acetaldehyde en co2, Ferro -geloof2+ Een ferrisch geloof geloof3+, ionjodide tot jodium, enz.
Maakt de omzetting van nitreuze-freesprees naar nitro-verbonden, sulfiden naar sulfonen. Het grijpt in de synthese van ketonen op basis van alkenen, zoals geoxideerd de hydrobored alkenen tot ketonen.
Verbindingen zeer resistent tegen gebruikelijke oxidatiemiddelen, zoals zuurstof of2 of waterstofperoxide h2OF2, Ze worden geoxideerd door chroomzuur. Dit is het geval van bepaalde heterocyclische bastesses.
In metaalanodisatieprocessen
Chroomzuuranodisatie is een elektrochemische behandeling die van toepassing is op aluminium om het vele jaren te beschermen tegen oxidatie, corrosie en slijtage.
Het anodisatieproces omvat de elektrochemische vorming van een laag aluminiumoxide of aluminiumoxide op metaal. Deze laag wordt vervolgens verzegeld in heet water, dat wordt bereikt door conversie naar trihydrated aluminiumoxide.
De afgesloten oxidelaag is dik, maar het is structureel zwak en niet erg bevredigend voor daaropvolgende lijmbonden. Door echter een kleine hoeveelheid chroomzuur toe te voegen aan afdichtingswater, wordt een oppervlak ontwikkeld dat goede bindingen kan vormen.
Kan u van dienst zijn: wet op het behoud van materieChroomzuur in afdichtingswater lost een deel van de celstructuur van het dikke -type op en laat een dunne, sterk, stevig bevestigd aan aluminiumoxide, waaraan de lijmen plakken en sterke en blijvende gewrichten vormen.
Anodisatie met chroomzuur is ook van toepassing op titanium en zijn legeringen.
In chemische conversiebehandelingen
Chroomzuur wordt gebruikt in metaalcoatingprocessen door chemische conversie.
Tijdens dit proces zijn metalen ondergedompeld in chroomzuuroplossingen. Dit reageert en lost gedeeltelijk het oppervlak op dat tegelijkertijd een dunne laag complexe chroomverbindingen die interageren met het basismetaal afsluiten.
Dit proces wordt chromat -conversiecoating of conversie chroom genoemd.
De metalen die over het algemeen worden onderworpen aan conversiechroom zijn verschillende soorten staal, zoals koolstofstaal, roestvrij staal en zinkcoated staal, en verschillende niet -ferrometalen, zoals magnesiumlegeringen, tinnen legeringen, aluminiumlegeringen, koper, cadmium, Mangaan en zilver.
Deze behandeling biedt corrosie- en helderheidsweerstand tegen metaal. Een hogere pH van het proces grotere weerstand tegen corrosie. De temperatuur versnelt de zure reactie.
Coating van verschillende kleuren kan worden toegepast, zoals blauw, zwart, goud, geel en transparant. Het biedt ook een betere naleving van het metalen oppervlak voor schilderijen en lijmen.
In geërodeerd of gehakt oppervlak
Chroomzuuroplossingen worden gebruikt bij de bereiding van het oppervlak van thermoplastisch materiaal, thermosystible polymeren en elastomeren voor latere coating met schilderijen of lijmen.
De H2Cro4 bereikt een effect op de oppervlaktechemie en de structuur ervan, omdat het helpt zijn ruwheid te vergroten. De combinatie van beten en oxidatie verhoogt de penetratie van lijmen en kan zelfs veranderingen in de polymeereigenschappen veroorzaken.
Het is gebruikt om vertakt polyethyleen te eroderen met lineaire polyethyleen met lage dichtheid, hoge dichtheid en polypropyleen.
Het wordt veel gebruikt in de elektro-receipt- of galvanoplastische industrie om metaalpolymeeradhesie te vergemakkelijken.
In verschillende toepassingen
Chroomzuur wordt gebruikt als een houten conserveermiddel, ook in magnetische materialen en voor chemische reacties katalyse.
Kroomzuurherstel
Er zijn veel processen die chroomzuur gebruiken en stromen of residuen genereren die chroom (III) bevatten die niet kunnen worden weggegooid omdat ze chroomionen (VI) hebben die zeer giftig zijn, of hergebruik zijn omdat de concentratie van chromaationen erg laag is.
De dispositie vereist de chemische reductie van chromaten tot chroom (III), gevolgd door neerslag van hydroxide en filtratie, die extra kosten genereert.
Om deze reden zijn verschillende methoden bestudeerd om chromaten te verwijderen en te herstellen. Hier zijn enkele hiervan.
Door gebruik van harsen
Al vele jaren zijn ionenuitwisselingsharsen voor chromat -besmette waterbehandeling gebruikt. Dit is een van de behandelingen die zijn goedgekeurd door het US Environmental Protection Agency of EPA (acroniem voor Engels Milieubeschermingsagentschap)).
Deze methode maakt het herstel van geconcentreerd chroomzuur mogelijk, omdat deze opnieuw wordt geregenereerd vanuit de hars.
Harsen kunnen een sterk of zwakke basis zijn. In sterk eenvoudige harsen kan het chromaat worden verwijderd als HCRO -ionen4- en Cr2OF72- Ze worden uitgewisseld met oh ionen- en Cl-. In zwak eenvoudige harsen, bijvoorbeeld sulfaat, worden ionen uitgewisseld met SOS42-.
Kan u van dienst zijn: nepelometrieIn het geval van sterk eenvoudige harsen R- (OH) zijn globale reacties als volgt:
2ROH + HCRO4- + H+ ⇔ r2Cro4 + 2h2OF
R2Cro4 + 2hcro4- ⇔ 2rhcro4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2OF7 + H2OF
Voor elke mol r2Cro4 Het omzetten van één mol Cr (VI) van de oplossing wordt verwijderd, waardoor deze methode zeer aantrekkelijk is.
Na het verwijderen van de chromaten wordt de hars behandeld met een sterk alkalische oplossing om ze op een veilige plaats te regenereren. Vervolgens worden de chromaten omgezet in geconcentreerd chroomzuur om te worden hergebruikt.
Door elektrochemische regeneratie
Een andere methode is de elektrochemische regeneratie van chroomzuur, wat ook een zeer handig alternatief is. Door deze procedure wordt chroom (III) oxidaal geoxideerd tot chroom (VI). Het anodemateriaal is in deze gevallen bij voorkeur looddioxide.
Het gebruik van micro -organismen om effluenten met chroomzuur te reinigen, blijft
Een methode die is onderzocht en nog steeds wordt bestudeerd, is het gebruik van micro -organismen die op natuurlijke wijze aanwezig zijn in bepaalde effluenten die zijn verontreinigd met hexavalent chroomionen die de inhoud zijn in chrominezuuroplossingen.
 Schadelijke effluenten voor het milieu. Auteur: OpenClipart-Vectors. Bron: Pixabay.
Schadelijke effluenten voor het milieu. Auteur: OpenClipart-Vectors. Bron: Pixabay. Dat is het geval van bepaalde bacteriën die aanwezig zijn in de wateren van het zonnebankwater. Deze microben zijn onderzocht en vastgesteld dat ze resistent zijn tegen chromaten en ook in staat zijn om chroom (VI) te verminderen tot chroom (III), wat veel minder schadelijk is voor de omgeving en levende wezens.
Om deze reden wordt geschat dat ze kunnen worden gebruikt als een milieu -vriendelijke methode voor de sanering en ontgifting van effluenten die zijn verontreinigd met chroomzuurresten.
Chroomzuurrisico's en chroomoxide
De Cro3 Het is geen brandstof, maar kan de verbranding van andere stoffen intensiveren. Veel van uw reacties kunnen brand of explosie veroorzaken.
De Cro3 en chrominezuuroplossingen zijn krachtige irriterende huid (ze kunnen dermatitis veroorzaken), ogen (kunnen ze verbranden) en slijmvliezen (kan bronchasma veroorzaken) en kunnen de zo -geramde "chromen hollows" veroorzaken in het ademhalingssysteem in het ademhalingssysteem.
Chrome verbindingen (VI) zoals chroomzuur en chroomoxide zijn ernstig giftig, mutagene en carcinogeen voor de meeste levende wezens.
Referenties
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Chroomzuur. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wegman, r.F. en van Twisk, J. (2013). Aluminium en aluminiumlegeringen. 2.5. Chroomzuur anodiseren proces. In oppervlaktebereidatietechnieken voor lijmbinding (tweede editie). Hersteld van Scientedirect.com.
- Wegman, r.F. en van Twisk, J. (2013). Magnesium. 6.4. Bereiding van magnesium- en magnesiumlegeringen door de chroomzuurbehandelingsprocessen. In oppervlaktebereidatietechnieken voor lijmbinding (tweede editie). Hersteld van Scientedirect.com.
- Grot, W. (2011). Toepassingen. 5.1.8. Chroomzuurregeneratie. In gefluoreerde ionomeren (tweede editie). Hersteld van Scientedirect.com.
- Swift, K.G. en Booker, J.D. (2013). Oppervlakte -engineeringproces. 9.7. Chromerend. In het handboek van productieprocessen selectie. Hersteld van Scientedirect.com.
- Poulson, a.H.C. et al. (2019). Oppervlakte -modificatietechnieken van PEEK, inclusief de behandeling van plasma -oppervlaktebedrijven. elf.3.2.1. Oppervlakte etsen. In Peek Biomaterials Handbook (tweede editie). Hersteld van Scientedirect.com.
- Westheimer, f.H. (1949). De mechanismen van chroomzuuroxidaties. Chemische beoordelingen 1949, 45, 3, 419-451. Hersteld van pubs.ACS.borg.
- Tan, h.K.S. (1999). Chroomzuur remival door anionuitwisseling. The Canadian Journal of Chemical Engineering, Volume 77, februari 1999. Opgehaald uit de online bibliotheek.Wiley.com.
- Kabir, m.M. et al. (2018). Isolatie en karakteritie van chroom (VI) -reducerende bacteriën uit leerloosterlijke effluenten en vaste afvalstoffen. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI hersteld.NLM.NIH.Gov.
- « Industriële landschapskenmerken, elementen en voorbeelden
- Moleculaire structuur cyanhydrinezuur, eigenschappen, gebruik »

