Carbonzuur
- 3249
- 349
- Lonnie Rohan
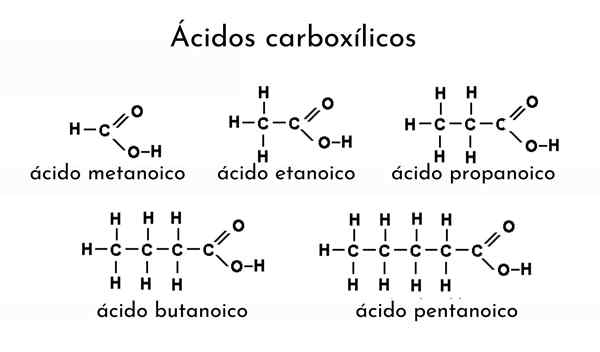
 Voorbeelden van carbonzuren
Voorbeelden van carbonzuren Wat zijn carbonzuren?
Hij carbonzuur Het is een term toegeschreven aan elke organische verbinding die een carboxylgroep bevat. Ze kunnen ook organische zuren worden genoemd en zijn aanwezig in veel natuurlijke bronnen. Bijvoorbeeld, van mieren en andere insecten zoals gallerietkever, mierenzuur, wordt een carbonzuur gedestilleerd.
Dat wil zeggen, een mierenhoop is een bron die rijk is aan mierenzuur. Ook wordt azijnzuur geëxtraheerd uit de azijn, de geur van ranzide boter is te wijten aan boterzuur, valeria -kruiden bevatten hersenzuur en van de doppen verkregen capriczuur, al deze carbonzuren.
Melkzuur geeft de slechte smaak van zure melk, en in sommige vetten en oliën zijn de vetzuren aanwezig. De voorbeelden van natuurlijke bronnen van carbonzuren zijn ontelbaar, maar al hun toegewezen namen zijn afgeleid van woorden in het Latijn. Dus in het Latijn het woord Formica betekent "mier".
Aangezien deze zuren in verschillende hoofdstukken van de geschiedenis werden geëxtraheerd, kwamen deze namen gebruikelijk, die in de populaire cultuur consolideren.
Formule
De Algemene formule van carbonzuur is -r -cooh, of meer details: R- (C = O) -OH. Het koolstofatoom is gekoppeld aan twee zuurstofatomen, wat een afname van zijn elektronische dichtheid veroorzaakt en bijgevolg een positieve gedeeltelijke belasting.
Deze belasting weerspiegelt de koolstofoxidatiestatus in een organische verbinding. In elke andere is koolstof zo roestig als in het geval van carbonzuren, deze oxidatie is evenredig met de mate van reactiviteit van de verbinding.
Om deze reden heeft de groep -COOH overheersend tegen andere organische groepen en definieert de belangrijkste koolzuurhoudende aard en de belangrijkste koolzuurhoudende keten van de verbinding.
Daarom zijn er geen zure derivaten van amines (R-NH2), maar amino's afgeleid van carbonzuren (aminozuren).
Nomenclatuur
Gemeenschappelijke namen afgeleid van het Latijn voor carbonzuren verduidelijken de structuur van de verbinding niet, of hun opstelling of beschikking van hun atomengroepen.
Gezien de noodzaak van deze verduidelijkingen, ontstaat IUPAC systematische nomenclatuur om carbonzuren te noemen.
Kan u bedienen: Bromine: geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruikDeze nomenclatuur wordt beheerst door verschillende regels, en sommige hiervan zijn:
Regel 1
Om een carbonzuur te noemen, moet de naam van het alkaan worden gewijzigd door het achtervoegsel "ICO" toe te voegen. Dus voor ethaan (kies3-Ch3) Het overeenkomstige carbonzuur is ethaanzuur (CH3-COOH, azijnzuur, hetzelfde van azijn).
Een ander voorbeeld: voor Cho3Ch2Ch2-COOH el Alcano wordt Butane (CH3Ch2Ch2Ch3) en daarom wordt butaanzuur (boterzuur, hetzelfde als ranzige boter) benoemd.
Regel 2
De -coo -groep definieert de hoofdketen en het aantal dat overeenkomt met elke koolstof wordt geteld uit carbonyl.
Bijvoorbeeld cho3Ch2Ch2Ch2-COOH is pentaanzuur en telt van één tot vijf koolstofatomen naar de methyl (kies3)). Als een andere methylgroep is gekoppeld aan de derde koolstof, zou het cho zijn3Ch2CH (Ch3) Ch2-COOH, nu de resulterende nomenclatuur: 3-methylpentaanzuur.
Regel 3
De substituenten worden voorafgegaan door het aantal koolstof waaraan ze zijn gekoppeld. Evenzo kunnen deze substituenten dubbele of drievoudige links zijn en het achtervoegsel "ICO" gelijk maken aan alkenen en alkines. Bijvoorbeeld cho3Ch2Ch2CH = CHCH2-COOH wordt genoemd als zuur (cis of trans) 3- heptenoic.
Regel 4
Wanneer de R -ketting uit een ring bestaat (φ). Het zuur wordt genoemd, beginnend met de naam van de ring en eindigend met het "carbonylische" achtervoegsel. De φ-Cooh wordt bijvoorbeeld genoemd als benzecenocarbonzuur.
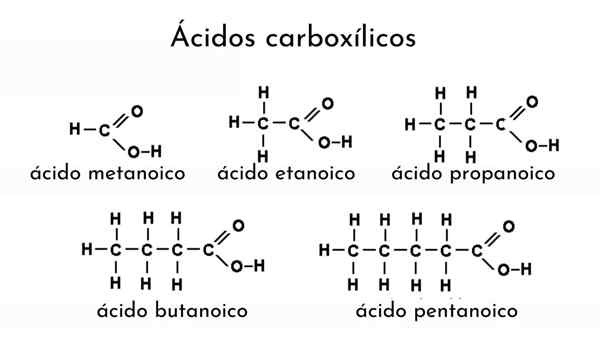
Carbonzuurstructuur
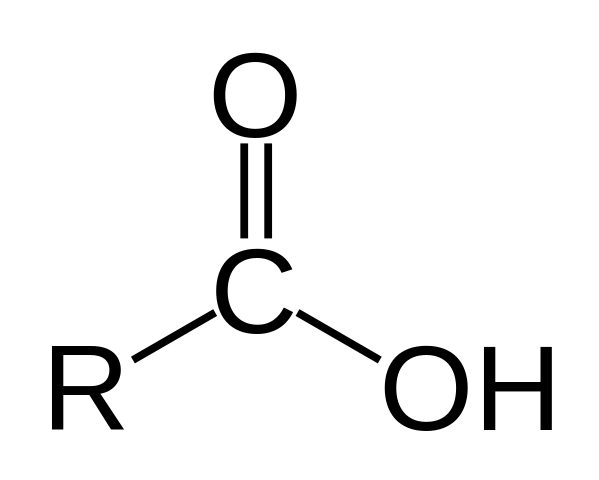 Structuur van een carbonzuur. R is een waterstof- of koolzuurhoudende ketting.
Structuur van een carbonzuur. R is een waterstof- of koolzuurhoudende ketting. In het bovenste beeld wordt de algemene structuur van carbonzuur weergegeven. Zij keten R kan van elke lengte zijn of van allerlei substituenten bezitten.
Het koolstofatoom heeft SP -hybridisatie2, waarmee u een dubbele binding kunt accepteren en linkhoeken van ongeveer 120º kunt genereren.
Daarom kan deze groep worden geassimileerd als een platte driehoek. De bovenste zuurstof is rijk aan elektronen, terwijl de onderste waterstof slecht is in elektronen en een zure waterstof wordt (elektronenacceptor). Dit is waarneembaar in resonantie structuren met dubbele binding.
Waterstof wordt toegewezen aan een basis, en om deze reden komt deze structuur overeen met een zuurverbinding.
Kan u van dienst zijn: aminesCarbonzuurseigenschappen
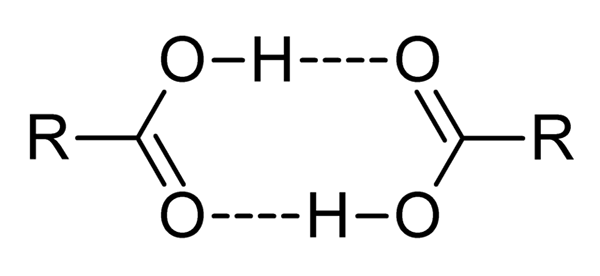
Carbonzuren zijn zeer polaire verbindingen, intense geuren en met het gemak om effectief met elkaar te interageren door waterstofbruggen, zoals geïllustreerd door het superieure beeld.
Wanneer twee carbonzuren op deze manier op elkaar inwerken, worden dímeros gevormd, sommige stabiel genoeg om in een gasfase te bestaan.
Bruggen van waterstof en diameter zorgen ervoor dat carbonzuren hogere kookpunten hebben dan water. Dit komt omdat de in warmte van warmte wordt verstrekt, niet alleen een molecuul moet verdampen, maar ook aan een dimeer, ook gekoppeld door deze waterstofbruggen.
Kleine carbonzuren voelen grote affiniteit voor water en polaire oplosmiddelen. Wanneer het aantal koolstofatomen echter groter is dan vier, overheerst het hydrofobe karakter van de R -ketens en wordt het niet onstijgbaar met water.
In vaste of vloeibare fase spelen de lengte van de R -keten en de substituenten die het bezit een belangrijke rol. Dus wanneer de ketens erg lang zijn, interageren ze met elkaar via de dispersiekrachten in Londen, zoals in het geval van vetzuren.
Zuurgraad
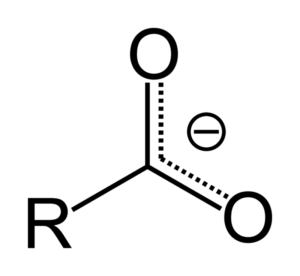
Wanneer carbonzuur een proton doneert, wordt het het carboxylaatanion, weergegeven in het bovenste beeld. In dit anion wordt de negatieve belasting verplaatst tussen de twee koolstofatomen, die deze stabiliseren en daarom de voorkeur geven aan de reactie.
Hoe varieert deze zuurgraad van het ene carbonzuur tot het andere? Het hangt allemaal af van de zuurgraad van het proton in de OH -groep: hoe arm in elektronen, hoe meer zuur.
Deze zuurgraad kan worden verhoogd als een van de RA -ketensubstituenten een elektronegatieve soort is (die de elektronische dichtheid uit zijn omgeving aantrekt of trekt).
Bijvoorbeeld in Cho3-COOH wordt een H van de methylgroep vervangen door een fluoratoom (CFH2-COOH) ZUURTIJD TE NEMENDE STREKKEN DIE VAN DE ELEKTRISCHE DENSITEIT VAN CARBONYL, ZUURGEN EN VAN HETROUWEN TRAGEN. Als alle H worden vervangen door F (CF3-COOH) Acidity bereikt zijn maximale waarde.
Kan u van dienst zijn: waterstof: geschiedenis, structuur, eigenschappen en gebruikWelke variabele bepaalt de mate van zuurgraad? De PKnaar. Hoe lager de PKnaar En dichter bij 1, groter is het vermogen van het zuur om in water te dissociëren en op zijn beurt gevaarlijker en schadelijker. Uit het vorige voorbeeld, CF3-COOH heeft de laagste PK -waardenaar.
Gebruik/toepassingen van carbonzuren
Vanwege de enorme verscheidenheid aan carbonzuren heeft elk van deze een potentiële toepassing in de industrie, of het nu gaat om polymeren, farmaceutisch of voedsel.
Voedselindustrie
- Additieven.
- Conserveermiddelen (sorbinezuur en benzoëzuur).
- Alkaliteitsregelaar van veel producten.
- Productie van frisdranken.
- Antimicrobiële middelen vóór de werking van antioxidanten. In dit geval is de trend vloeibaar antimicrobieel.
- Hoofdingrediënt van gewone azijn (azijnzuur).
- Acidulant in koolzuurhoudende dranken en voedsel (citroenzuur en melkzuur).
- Assistent in de rijping van Zwitserse kaas (propionzuur).
- Kaas, chucrut, gefermenteerde colm en frisdranken (melkzuur).
Farmaceutische industrie
- Antipyretisch en analgetisch (acetylsalicylzuur).
- Actief in het proces van aroma -synthese, in sommige geneesmiddelen (Butyric of butaanzuur).
- Antimicotisch (benzoëzuur gecombineerd met salicylzuur).
- Actief voor de productie van vitamine C -geneesmiddelen (ascorbinezuur).
- Fungicide (Caprilinezuur).
- Vervaardiging van sommige laxeermiddelen (hydroxybothanodiumzuur).
Andere industrieën
- Vervaardiging van kunststoffen en smeermiddelen (sorbinezuur).
- Vervaardiging van vernissen, elastische harsen en transparante lijmen (acrylzuur).
- Vervaardiging van schilderijen en vernissen (linolzuur).
- Vervaardiging van zeep, wasmiddelen, shampoos, cosmetica en metaalreinigingsproducten (oliezuur).
- Tandheelkundige pasta -productie (salicylzuur).
- Rayon -acetaatproductie, fotografische films en oplosmiddelen voor verf (azijnzuur).
- Kleurstof en gebruinde productie (methaanzuur).
- Bereiding van smeeroliën, waterdichte materialen en secant schilderijen (palmitinezuur).
- Rubberen productie (azijnzuur).
- Rubber uitwerking en galvanoplastiek.
- Oplosmiddel.
- Parfumproductie (benzoëzuur).
- Vervaardiging van weekmakers en harsen (fotozuur).
- Polyester uitwerking (terventallic acid).
- Bereiding van paraffinekaarsen (stearinezuur).
Referenties
- Graham Solomons T.W., Craig B. Friteuse. Organische chemie. Carbonzuren en hun derivaten (10e editie., pagina 779-783). Wiley Plus.
- Organische zuren. Naturalwellbeing hersteld.com
- Francis a. Schildpad. Organische chemie. Carbonzuren. (zesde editie., Pagina 805-820). MC Graw Hill.
- William Reusch. Carbonzuren. Hersteld van chemie.MSU.Edu
- « Kenmerken en risicofactoren van biodiversiteit in Mexico
- De 5 takken van de belangrijkste biotechnologie »

