Elektrochemische cellen

- 4665
- 1424
- Irving McClure I
Wat zijn elektrochemische cellen?
De elektrochemische cellen Het zijn apparaten waarin chemische reacties passeren waar chemische energie wordt omgezet in elektriciteit of vice versa. Deze cellen vormen het hart van de elektrochemie, de ziel is de potentiële uitwisseling van elektronen die kunnen optreden, spontaan of niet spontaan, tussen twee chemische soorten.
Een van de twee soorten oxideert, verliest elektronen, terwijl de andere wordt verminderd door het winnen van de afgestudeerde elektronen. Gewoonlijk is de soort die wordt verminderd een metalen kation in oplossing, die door elektrisch te winnen elektrisch worden op een elektrode die van hetzelfde metaal wordt gemaakt. Aan de andere kant is de soort die oxideert een metaal, met metaalkationen worden.
 Daniel's elektrochemische celdiagram. Bron: Rechua [CC door (https: // creativeCommons.Org/licenties/door/3.0)]
Daniel's elektrochemische celdiagram. Bron: Rechua [CC door (https: // creativeCommons.Org/licenties/door/3.0)] Het superieure beeld vertegenwoordigt bijvoorbeeld de cel van Daniel: de eenvoudigste van alle elektrochemische cellen. De metalen zinkelektrode is geoxideerd, waardoor Zn -kationen worden vrijgelaten2+ naar de waterige omgeving. Dit gebeurt in de ZnSO -container4 van links.
Aan de rechterkant, de oplossing die CUO bevat4 Het is verminderd, transformerende kationen cu2+ In metaalkoper dat wordt afgezet op de koperelektrode. Tijdens de ontwikkeling van deze reactie reizen elektronen op een extern circuit dat hun mechanismen activeert; En daarom, het bieden van elektriciteit voor de werking van een apparatuur.
Elektrochemische celcomponenten
Elektroden
In elektrochemische cellen worden gegenereerd of geconsumeerd. Om een goede stroom van elektronen te garanderen, moeten er materialen zijn die goede elektriciteitsgeleiders zijn. Dit is waar elektroden en extern circuit komen, voorzien van koperen bedrading, zilver of goud.
De elektroden zijn de materialen die het oppervlak leveren waar reacties in elektrochemische cellen zullen worden ontwikkeld. Er zijn twee soorten volgens de reactie die erin voorkomt:
- Anode, elektrode waar oxidatie optreedt.
- Kathode, elektrode waarbij de reductie optreedt.
De elektroden kunnen worden gemaakt van een reagerend materiaal, zoals in het geval van Daniel's cel (zink en koper); of, van een inert materiaal, zoals het geval is wanneer ze zijn gemaakt van platina of grafiet.
Elektronen die door de anode zijn toegewezen, moeten de kathode bereiken; Maar niet door een oplossing, maar een metalen kabel reizen die beide elektroden aansluit bij een extern circuit.
Elektrolytoplossing
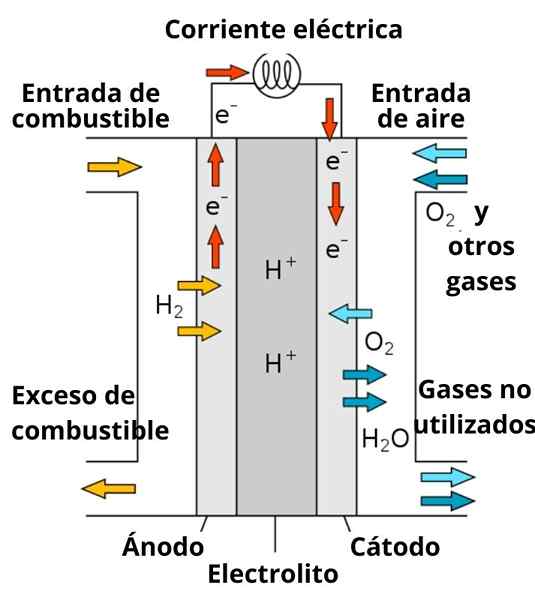 Schema van een protonen geleidende brandstofbatterij
Schema van een protonen geleidende brandstofbatterij De oplossing die de elektroden omringt, speelt ook een belangrijke rol, omdat deze wordt verrijkt met sterke elektrolyten; zoals: KCL, kno3, NaCl, etc. Deze ionen bevorderen tot op zekere hoogte de migratie van elektronen van de anode naar de kathode, evenals hun geleiding door de buurt van de elektroden om te communiceren met de soort om te verminderen.
Zeewater leidt bijvoorbeeld veel betere elektriciteit dan gedestilleerd water, met lagere ionenconcentratie. Daarom hebben elektrochemische cellen een oplossing van sterke elektrolyten onder hun componenten.
Zoutoplossing
De ionen van de oplossing beginnen de elektroden te omringen die een polarisatie van de belastingen veroorzaken. De oplossing rond de kathode begint negatief te laden, omdat kationen worden verminderd; In het geval van de cel van Daniel, Cu -kationen2+ Door af te zetten als een metaalachtig koper op de kathode. Er is dus een tekort aan positieve ladingen.
Hier komt de zoutoplossing -brug tussenbeide om de belastingen in evenwicht te brengen en te voorkomen dat de elektroden worden gepolariseerd. Aan de zijkant of compartiment van de kathodekationen van de zoutoplossing zullen migreren, ofwel k+ of Zn2+, Om de Cu te vervangen2+ verbruikt. Ondertussen zal van de zoutoplossing -brug anionen migreren3- Naar het anodecompartiment, om de groeiende concentratie van Zn -kationen te neutraliseren2+.
Het kan u van dienst zijn: kaliumdichromaat: formule, eigenschappen, risico's en gebruikDe zoutoplossing is samengesteld uit een verzadigde zoutenoplossing, met zijn uiteinden bedekt door een permeabele iongel, maar waterdicht voor water.
Soorten elektrochemische cellen en hoe ze werken
De manier waarop een elektrochemische cel werkt, hangt af van het type dat is. Er zijn fundamenteel twee soorten: galvanisch (of voltaic) en elektrolytisch
Galvanica
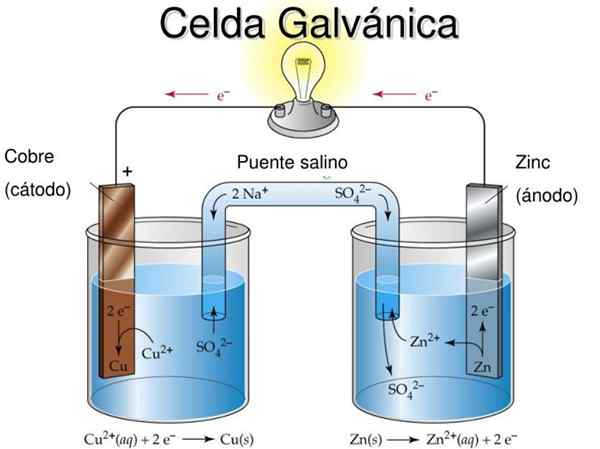
Daniel's cel is een voorbeeld van een galvanische elektrochemiecel. Daarin komen de reacties spontaan voor en het potentieel van de batterij is positief; Hoe groter het potentieel, hoe groter de elektriciteit die de cel zal leveren.
De batterijen of batterijen zijn precies galvanische cellen: de chemische potentiaal tussen de twee elektroden wordt omgezet in elektrische energie wanneer een extern circuit tussenbeide komt dat ze verbindt. Aldus migreren elektronen vanaf de anode, steek de apparatuur aan waarop de batterij is aangesloten en worden rechtstreeks naar de kathode geretourneerd.
Elektrolytisch
Elektrolytische cellen zijn die wiens reacties niet spontaan optreden, tenzij ze worden geleverd door elektrische energie uit een externe bron. Hier treedt het tegenovergestelde fenomeen voor: elektriciteit zorgt ervoor dat niet -spontane chemische reacties zich ontwikkelen.
Een van de bekendste en waardevolle reacties die plaatsvindt binnen dit type cel is elektrolyse.
Oplaadbare batterijen zijn voorbeelden van elektrolytisch en tegelijk.
Voorbeelden
Daniel's cel
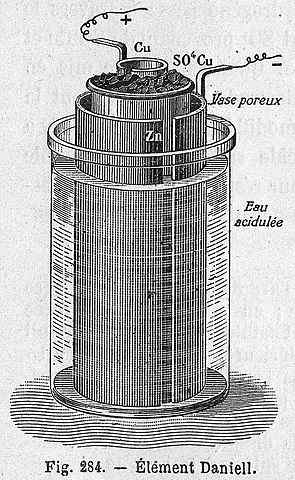 Daniel's celschema
Daniel's celschema De volgende chemische vergelijking komt overeen met de reactie van de cel van Daniel waar zink en koper deelnemen:
Kan u van dienst zijn: HUREN HALOGENUROS: Eigenschappen, verkrijgen, voorbeeldenZn (S) + Cu2+(aq) → Zn2+(aq) + cu (s)
Maar cations2+ en Zn2+ Ze zijn niet alleen maar vergezeld door de So Anions42-. Deze cel kan als volgt worden weergegeven:
Zn | ZnSo4 | | Cuso4 | Cu
Daniel's cel kan in elk laboratorium worden gebouwd, die erg terugkerend is als een praktijk bij de introductie van elektrochemie. Zoals Cu2+ Het wordt afgezet als CU, de blauwe kleur van de CUSO -oplossing4 Het zal verloren gaan.
Platina en waterstofcel
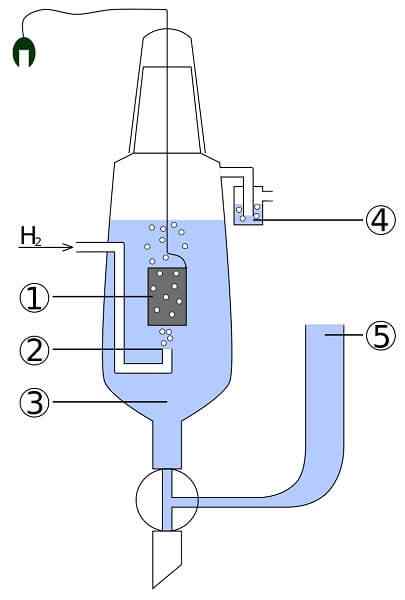 Schema van een platina- en waterstofcel: 1. 2 platina -elektrode. Waterstofgas 3. Zure oplossing 4. Hidroseal 5. Borg
Schema van een platina- en waterstofcel: 1. 2 platina -elektrode. Waterstofgas 3. Zure oplossing 4. Hidroseal 5. Borg Stel je een cel voor die gasvormige waterstof verbruikt, metaalzilver produceert en tegelijkertijd elektriciteit nodig heeft. Dit is de platina- en waterstofcel, en de algemene reactie ervan is als volgt:
2agcl (s) + h2(g) → 2ag (s) + 2H+ + 2cl-
Hier in het anodecompartiment hebben we een inerte platina -elektrode, ondergedompeld in water en waarmee gaswaterstof wordt gepompt. De H2 word geoxideerd naar h+ en levert zijn elektronen op aan het melkachtige neerslag van Agcl in het kathodecompartiment met een metalen zilverelektrode. AGCL zal worden verminderd op dit zilver en het elektrode -deeg zal toenemen.
Deze cel kan worden weergegeven als:
PT, H2 | H+ | | Klet-, Agcl | Ag
Downs Cell
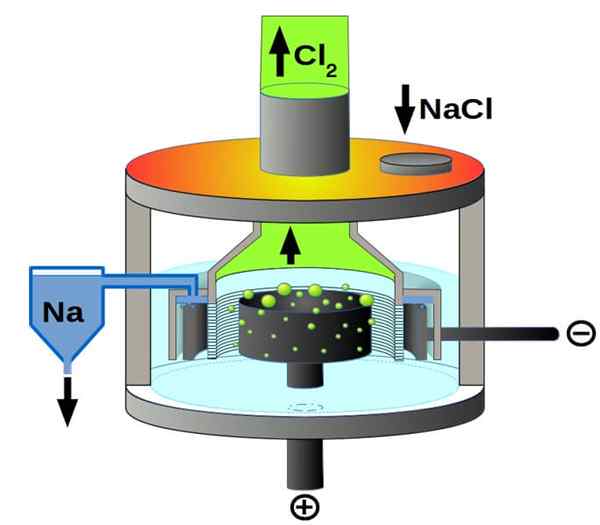 Downs -celschema voor natriumchloride -elektrolyse. Bron: PCHEMIKER, CC BY-SA 4.0, via Wikimedia Commons
Downs -celschema voor natriumchloride -elektrolyse. Bron: PCHEMIKER, CC BY-SA 4.0, via Wikimedia Commons En ten slotte hebben we onder de elektrolytische cellen het gesmolten natriumchloride, beter bekend als downs -cel. Hier wordt elektriciteit gemaakt om door de elektroden een volume gesmolten NaCl te reizen, en ontstaat er dus de volgende reacties in:
2e+(l) + 2e- → 2na (s) (kathode)
2cl-(L) → Cl2(g) + 2e- (anode)
2Nacl (L) → 2NA (S) + Cl2(g) (globale reactie)
Dankzij elektriciteit en natriumchloride kunnen metallisch natrium- en chloorgas dus worden bereid.

