Koolstof

- 4772
- 457
- James Dach
Wat is koolstof?
Hij koolstof Het is een niet -metalen chemisch element waarvan het chemische symbool C is. De naam is te wijten aan kolen, groente of mineraal, waar de atomen verschillende structuren definiëren. Het vormt een breed scala aan organische en anorganische verbindingen en presenteert zich ook in een aanzienlijk aantal alotropen.
Koolstof wordt gevonden in alle levende wezens; Al zijn biomoleculen hebben zijn bestaan te danken aan de stabiliteit en sterkte van de C-C-bindingen en hun hoge neiging om aan te komen. Het is het element van het leven, en met hun atomen zijn hun lichamen gebouwd.
De organische verbindingen waarmee biomaterialen worden gebouwd, bestaan uit koolzuurhoudende en heteroatomen skeletten. Deze zijn op het eerste gezicht in het hout van de bomen te zien; En ook, wanneer bliksem op hen en Rostiza valt. De resterende inerte zwarte vaste stof heeft ook koolstof; Maar het is houtskool.
CO2 -eigenschappen
De fysische of chemische eigenschappen die worden gevonden in vaste stoffen, mineralen of koolstofhoudende materialen zijn onderworpen aan veel variabelen. Onder hen zijn: de samenstelling of mate van onzuiverheden, de hybridaties van koolstofatomen, de diversiteit van de structuren en de morfologie of grootte van de poriën.
Wanneer de eigenschappen van koolstof beschrijven, zijn de meeste bibliografische teksten of bronnen gebaseerd op grafiet en diamant.
Omdat? Omdat ze de bekendste alotropen zijn voor dit element en vaste stoffen of hoge zuiverheidsmaterialen vertegenwoordigen; dat wil zeggen, ze zijn praktisch niets meer gemaakt dan koolstofatomen (hoewel met verschillende structuren, zoals in de volgende sectie zal worden verklaard).
De eigenschappen van groente- en minerale steenkool verschillen respectievelijk in hun oorsprong of composities. Bijvoorbeeld, bruinkool (slechte koolstof) als een Gatea -brandstof in vergelijking met antraciet (koolstofrijk). En wat te zeggen over de andere Alotropes: Nanotubes, Fullerenos, Graphene, Graphos, etc.
Ze hebben echter chemisch een gemeenschappelijk punt: ze oxideren met een teveel aan zuurstof in CO2:
C + OF2 => CO2
Nu zijn de snelheid of temperatuur die ze nodig hebben om te oxideren voor elk van deze alotropen.
Grafiet versus diamant
Hier zal ook een korte opmerking worden gemaakt over de verschillende eigenschappen voor deze twee alotropen:
 Tabel waarin sommige eigenschappen van de twee kristallijne alotrops van koolstof worden vergeleken. Bron: Gabriel Bolívar.
Tabel waarin sommige eigenschappen van de twee kristallijne alotrops van koolstof worden vergeleken. Bron: Gabriel Bolívar. Elektronische structuur en configuratie
Hybridaties
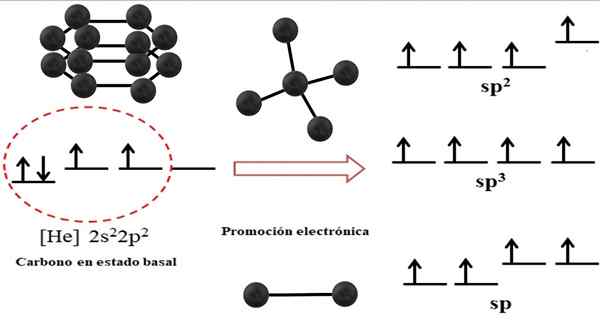 Relatie tussen hybride orbitalen en mogelijke structuren voor koolstof. Bron: Gabriel Bolívar.
Relatie tussen hybride orbitalen en mogelijke structuren voor koolstof. Bron: Gabriel Bolívar. De elektronische configuratie voor het koolstofatoom is 1s22s22 p2, ook geschreven als [hij] 2s22 p2 (bovenste afbeelding). Deze weergave komt overeen met zijn basale status: het koolstofatoom geïsoleerd en gesuspendeerd in een dergelijk vacuüm dat niet met anderen kan communiceren.
Kan u van dienst zijn: kristallijne structuurHet wordt op prijs gesteld dat een van de 2P -orbitalen geen elektronen missen, die een elektron van het kleinere energie -orbitaal accepteren door elektronische promotie; En dus verwerft het atoom het vermogen om maximaal vier covalente bindingen te vormen via zijn vier SP hybride orbitalen3.
Merk op dat de vier orbitalen sp3 Ze worden gedegenereerd in energie (uitgelijnd op hetzelfde niveau). De orbitalen P Pure zijn energieker, daarom staan ze boven de andere hybride orbitalen (rechts van de afbeelding).
Als er drie hybride orbitalen zijn, komt dat omdat een orbitale overblijfselen P zonder te hybridiseren; Daarom zijn het drie sp orbitalen2. En wanneer er twee van deze hybride orbitalen zijn, twee orbitalen P Ze zijn beschikbaar om dubbele of drievoudige bindingen te vormen, zijnde de hybridisatie van de F -koolstof.
Dergelijke elektronische aspecten zijn essentieel om te begrijpen waarom koolstof in Alotropes Infinities kan worden gevonden.
Oxidatienummers
Voordat u doorgaat met de structuren, zijn het niet anderen om te vermelden dat, gezien de elektronische configuratie van Valencia 2s22 p2, Koolstof kan de volgende oxidatienummers hebben: +4, +2, 0, -2 en -4.
Omdat? Deze getallen komen overeen met de veronderstelling dat er een ionische binding is zodat u de ionen met de respectieve belastingen vormt; dat wil zeggen c4+, C2+, C0 (Neutraal), C2- en C4-.
Om koolstof een positief oxidatienummer te hebben, moet het elektronen verliezen; En om het te doen, moet het noodzakelijkerwijs worden gekoppeld aan zeer elektronegatieve atomen (zoals zuurstof).
Ondertussen moet het, om koolstof een negatief oxidatienummer te hebben, elektronen verkrijgen die koppelen aan metaal of minder elektronegatieve atomen dan hij (zoals waterstof).
Het eerste oxidatieprobleem, +4, betekent dat koolstof alle valentie -elektronen heeft verloren; De orbitalen 2s en 2p zijn leeg. Als de 2P orbitaal zijn twee elektronen verliest, heeft de koolstof +2 oxidatienummer; Als je twee elektronen wint, heb je -2; En als hij twee elektronen wint die zijn octet meer voltooit van Valencia, -4.
Voorbeelden
Bijvoorbeeld voor CO2 Het koolstofoxidatienummer is +4 (omdat zuurstof meer elektronegatief is); Terwijl voor Cho4, is -4 (omdat waterstof minder elektronegatief is).
Kan u van dienst zijn: Hydrazine: structuur, eigenschappen, synthese, gebruikVoor ch3Oh, het koolstofoxidatienummer is -2 (+1 voor H en -2 voor O); Terwijl voor HCOOH, het is +2 (controleer of de som van 0).
Andere oxidatietoestanden, zoals -3 en +3, zijn ook waarschijnlijk, vooral als het gaat om organische moleculen; Bijvoorbeeld, in methylgroepen, -CH3.
Moleculaire geometrieën
In het superieure beeld werden niet alleen de hybridisatie van de orbitalen voor het koolstofatoom getoond, maar ook de resulterende moleculaire geometrieën wanneer verschillende atomen (zwarte bollen) zijn gekoppeld aan een centrale. Dit centrale atoom om een specifieke geometrische omgeving in de ruimte te verwijderen, moet de respectieve chemische hybridisatie bezitten die is toegestaan.
Voor de tetraëder heeft bijvoorbeeld de centrale koolstof SP -hybridisatie3; Omdat dit de meest stabiele opstelling is voor de vier hybride SP3. In het geval van SP -koolstofatomen2, Ze kunnen dubbele links vormen en een trigonale platte omgeving weggooien; En dus definiëren deze driehoeken een perfecte zeshoek. En voor een SP -hybridisatie nemen koolstoffen lineaire geometrie aan.
Aldus worden de geometrieën waargenomen in de structuren van alle alotropen eenvoudig geregeld in tetrahedra (sp3), hexagons of pentagons (sp2) en lijnen (sp).
Tetrahedra definieert een 3D -structuur, terwijl zeshoeken, pentagons en lijnen, 3D- of 2D -structuren; De laatste worden de vliegtuigen of vellen vergelijkbaar met de muren van de bijenhoningraten:
 Muur met zeshoekige ontwerpen van een bijenhoningraat in analogie met de vliegtuigen bestaande uit SP2 -koolstofatomen. Bron: Pixabay.
Muur met zeshoekige ontwerpen van een bijenhoningraat in analogie met de vliegtuigen bestaande uit SP2 -koolstofatomen. Bron: Pixabay. En als we deze zeshoekige muur vouwen (vijfhoekig of gemengd), zullen we een buis (nanobuisjes) of een bal (fullereen) krijgen, of een ander figuur. De interacties tussen deze cijfers geven aanleiding tot verschillende morfologieën.
Amorfe of kristallijne vaste stoffen
Geometrieën, hybridisaties of morfologieën van de mogelijke koolstofstructuren achterlaten, kunnen hun vaste stoffen wereldwijd in twee soorten classificeren: amorf of kristallijn. En tussen deze twee classificaties zijn hun alotropen gedistribueerd.
Amorfe koolstof is gewoon degene die een willekeurig mengsel van tetrahedra, zeshoeken of lijnen presenteert, niet in staat om een structureel patroon vast te stellen; Dat is het geval van steenkool, groente of geactiveerde steenkool, cola, roet, enz.
Terwijl kristallijne koolstof bestaat uit structurele patronen gevormd door een van de verhoogde geometrieën; Bijvoorbeeld, diamant (drie -dimensionaal tetrahedra -netwerk) en grafiet (gestapelde zeshoekige vellen).
Kan u van dienst zijn: natriumnitraat (nano3): structuur, eigenschappen, gebruik, risico'sWaar is koolstof?
Naast het chemische element dat gemeenschappelijk is in alle levensvormen, is koolstof in de natuur aanwezig in drie kristallijne vormen: diamant, grafiet en gids.
Er zijn ook verschillende amorfe kolenminerale vormen (antraciet, bruinkool, dom, veen), vloeibare vormen (variëteiten van aardolie) en frisdrank (aardgas).
Toepassingen
Nogmaals, net als de eigenschappen en structuur zijn het gebruik of toepassingen consistent met de alotrogo's of mineralogische vormen van koolstof. Er zijn echter bepaalde algemeenheden die kunnen worden vermeld, naast enkele zeer bekende punten. Dat zijn:
-Koolstof wordt al lang gebruikt als een mineraal reductiemiddel bij het verkrijgen van zuivere metalen; Bijvoorbeeld ijzer, silicium en fosfor, onder andere.
-Het is de hoeksteen van het leven, en organische chemie en biochemie zijn de studies van deze reflectie.
-Het is ook een fossiele brandstof geweest waarmee de eerste machines naar hun versnellingen konden gaan. Op dezelfde manier werd koolstofgas voor oude verlichtingssystemen van hem verkregen. Steenkool was synoniem met licht, warmte en energie.
-Gemengd als een additief met ijzer in verschillende verhoudingen maakte de uitvinding en verbetering van staals.
-De zwarte kleur vond plaats in kunst, vooral grafiet en alle geschriften gemaakt met hun slagen.
Risico's en voorzorgsmaatregelen
Koolstof en zijn vaste stoffen vormen geen gezondheidsrisico. Die zich zorgen maakt over een kolentas? Ze verkopen ze aan kavels in de gangen van sommige markten, en zolang er geen bijna vuur is, zullen hun zwarte blokken niet branden.
De cola daarentegen kan een risico vertegenwoordigen als het zwavelgehalte hoog is. Wanneer de verbranding zwavelgassen vrijgeeft die, naast giftig zijn, bijdragen aan zure regen. En hoewel de CO2 In kleine hoeveelheden kan het ons niet verstikken, het heeft een enorme impact op het milieu als broeikasgas.
Vanuit dit perspectief is koolstof een "langetermijn" gevaar, omdat de verbranding ervan het klimaat van onze planeet verandert.
En in meer fysieke zin, vaste stoffen of koolstofhoudende materialen als ze worden gespoten, worden gemakkelijk getransporteerd door luchtstromen; En bijgevolg worden ze rechtstreeks op de longen geïntroduceerd, die ze niet kunnen beschadigen.
Van de rest is het heel gebruikelijk om 'steenkool' te consumeren wanneer wat voedsel kookt.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.

