Zinkcarbonaat (ZnCo3) structuur, eigenschappen, gebruik

- 1220
- 304
- Dr. Rickey Hudson
Hij zinkcarbonaat Het is een anorganische verbinding gevormd door het zink (Zn), koolstof (C) en zuurstof (O) elementen (O). De chemische formule is Znco3. Zink heeft een oxidatietoestand van +2, koolstof +4 en zuurstof -2.
Het is een kleurloze of witte vaste stof die in de natuur wordt gevonden die het Smithsonite -mineraal vormt, waarin het alleen of met andere elementen zoals kobalt of koper kan zijn, die het respectievelijk een violet of groene kleur geven.
 Smithsonita, Znco Mineral3. Rob Lavinsky, irocks.com-cc-by-sa-3.0/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, irocks.com-cc-by-sa-3.0/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. De Znco3 Het is bijna onoplosbaar in water, maar het wordt gemakkelijk opgelost in verdunde zuren, als het carbonaation in zure carbononische vorm (h2CO3), die dan het CO -gas wordt2 en water.
Het wordt gebruikt als een antisepticum bij dierenwonden en wordt soms in het dieet geleverd om ziekten te voorkomen die worden veroorzaakt door zinktekort.
Het dient om de verbrande uit te stellen dat bepaalde vezels, kunststoffen en tandvlees wanneer ze in contact komen met vuur. Maakt het mogelijk om giftige arseenmineralen van andere rotsen veilig te scheiden.
Het is gebruikt in dentifric pastes om dentine in de tanden te herstellen onder bleken.
[TOC]
Structuur
De Znco3 Het wordt gevormd door een Zn -kation2+ en een anion co32-. Koolstof in het carbonaation heeft een oxidatietoestand van +4. Dit ion heeft een vlakke structuur met de drie zuurstofatomen rondom het koolstofatoom.
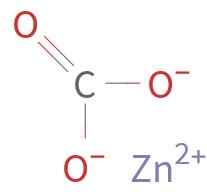 Chemische structuur van zinkcarbonaat. Onbekend auteur / public domein. Bron: Wikimedia Commons.
Chemische structuur van zinkcarbonaat. Onbekend auteur / public domein. Bron: Wikimedia Commons. Nomenclatuur
- Zinkcarbonaat
- Zinkmonocarbonaat
- Koolzuur zinkzout
- Smithsonita
- Zink spuug
Eigenschappen
Fysieke staat
Kleurloze vaste of kristallijn wit. Rombische kristallen.
 Zinkcarbonaat. Ondřej Mangl / Pub -domein. Bron: Wikimedia Commons.
Zinkcarbonaat. Ondřej Mangl / Pub -domein. Bron: Wikimedia Commons. Molecuulgewicht
125,4 g/mol
Smeltpunt
Bij 140 ºC breekt het af zonder te smelten.
Dikte
4.398 g/cm3 bij 20 ° C.
Oplosbaarheid
Praktisch onoplosbaar in water: 0,000091 g/100 g h H2Of bij 20 ° C. Oplosbaar in verdunde zuren, alkalis en ammoniumzouten. Onoplosbaar in ammoniak, alcohol en aceton.
Chemische eigenschappen
Reageert met zuren die koolstofdioxide vormen:
Znco3 + 2 H+ → Zn2+ + H2Of + co2↑
Het lost op in basen die hydroxide vormen, dat gedeeltelijk is opgelost dat een ion van zinkato vormt:
Kan u bedienen: Bromine: geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruikZnco3 + 2 oh- → Zn (OH)2 + CO32-
Zn (OH)2 + H2Of + oh- → [Zn (OH)3(H2OF)]-
Het is niet ontvlambaar. Bij verhit tot zijn ontleding produceert zinkoxide en koolstofdioxide, maar kan koolmonoxide (CO) uitstoten.
Znco3 + Verwarm → ZnO + CO2↑
Het verkrijgen van
Het Smithsonite -mineraal wordt verkregen, voorheen zink's spuug genoemd.
Het kan ook worden bereid door een natriumcarbonaatoplossing te mengen met een zinkzout, zoals zinksulfaat. Natriumsulfaat blijft opgelost en zinkcarbonaatprecipitaten:
ZnSo4 + NA2CO3 → Znco3↓ + NA2SW4
Toepassingen
In medische behandelingen
Met deze verbinding kunt u enkele farmaceutische producten verkrijgen. Het wordt toegepast op de ontstoken huid in de vorm van stof of lotion.
In veterinaire toepassingen
De Znco3 Het dient als een samentrekkende, antiseptische en actuele beschermer van dieren bij dieren.
Het maakt het ook mogelijk om ziekten veroorzaakt door zinktekort te voorkomen, dus wordt het gebruikt als een supplement in het dieet van sommige dieren, op voorwaarde dat de toegediende hoeveelheden zich binnen de normen bevinden die door gezondheidsinstanties zijn vastgesteld.
 Zinkcarbonaat wordt soms toegediend als een micronutriënt om ziekten bij varkens te voorkomen. Onbekende auteur / cc0. Bron: Wikimedia Commons.
Zinkcarbonaat wordt soms toegediend als een micronutriënt om ziekten bij varkens te voorkomen. Onbekende auteur / cc0. Bron: Wikimedia Commons. Bij uitbraken van porcheratose bij varkens wordt het toegevoegd aan het dieet hiervan. Deze ziekte is een wijziging van de huid waarin de hoornvlieslaag niet goed is gevormd.
Als vlamvertragende
Het wordt gebruikt als brandwerende vulling voor rubber en kunststoffen die worden blootgesteld aan hoge temperaturen. Hiermee kunt u textielvezels beschermen tegen vuur.
In het geval van katoenen textiel wordt het op de stof toegepast, samen met wat alkali. Dit valt rechtstreeks primaire hydroxylgroepen aan (-CH2Oh) van cellulose en maakt ze sodiocellulose (-CH2OP EEN).
De breuk van cellulosekoppelingen door de alkali bevordert een grotere penetratie van de ketens van de compacte cellulosestructuur, zodat meer Znco -hoeveelheid3 slaagt erin om de amorfe zone hiervan binnen te gaan en de dispersie ervan wordt vergemakkelijkt.
Kan u van dienst zijn: vanadium: geschiedenis, eigenschappen, structuur, gebruik Sommige katoenen stoffen kunnen Znco bevatten3 in hun vezels om hen bestand te maken tegen vuur. Socken_farbig.JPEG: Scott Bauererivative Work: Sock / Public Domain. Bron: Wikimedia Commons.
Sommige katoenen stoffen kunnen Znco bevatten3 in hun vezels om hen bestand te maken tegen vuur. Socken_farbig.JPEG: Scott Bauererivative Work: Sock / Public Domain. Bron: Wikimedia Commons. Als gevolg hiervan wordt de hoeveelheid ontvlambaar gas die met brand zou kunnen optreden, verminderd.
In tandheelkundige behandelingen
Bepaalde dentifric crèmes op basis van zinkcarbonaat nanokristallen en hydroxyapatiet die regelmatig worden aangebracht op prothese om overgevoeligheid effectiever te verminderen dan die op basis van fluoride.
De nanokristallen van Znco3 en hydroxiapatiet hebben een grootte, vorm, chemische samenstelling en kristalliniteit vergelijkbaar met die van de dentine, zodat de dentinale tubuli kunnen worden gesloten met de toepassing van deze materialen.
 Znco nanodeeltjes3-Hydroxiadiet is met succes getest om de gevoeligheid in gebleekte tanden te verminderen. Auteur: fotomix. Bron: Pixabay.
Znco nanodeeltjes3-Hydroxiadiet is met succes getest om de gevoeligheid in gebleekte tanden te verminderen. Auteur: fotomix. Bron: Pixabay. Dit type dentifric -pasta's waren nuttig na tandheelkundige blekenprocessen.
Om gevaarlijke arseenmineralen te scheiden
Arseen minerale methoden van zwavelrotsen (zoals galena, chalcopyriet en pyriet) zijn getest met behulp van ZnCo)3. Het erts in arseen moet van anderen worden gescheiden omdat dit element een zeer giftige en giftige verontreinigende stof is voor levende wezens.
Om dit te bereiken, wordt het mengsel van grondrotsen behandeld met een zinksulfaatoplossing en natriumcarbonaat tot een pH van 7,5-9,0 en een Xantate-verbinding.
 Arsenopirita. Dit mineraal moet van anderen worden gescheiden omdat het arseen giftig bevat. Scheiding kan worden bereikt met zinkcarbonaat. James St. John/CC door (https: // creativeCommons.Org/licenties/door/2.0). Bron: Wikimedia Commons.
Arsenopirita. Dit mineraal moet van anderen worden gescheiden omdat het arseen giftig bevat. Scheiding kan worden bereikt met zinkcarbonaat. James St. John/CC door (https: // creativeCommons.Org/licenties/door/2.0). Bron: Wikimedia Commons. De effectiviteit van de formule wordt toegeschreven aan de vorming van kleine Znco -deeltjes3 Op het oppervlak van het arsenopyriet waardoor het hydrofiel is (gerelateerd aan water), zodat u niet aan luchtbellen kunt hechten en niet kunt drijven, neerslaan en scheiden van de andere mineralen.
Bij het verkrijgen van andere zinkverbindingen
Zinkcarbonaat is gebruikt om hydrofobe nanostructuren van boraat van formule 3zno te verkrijgen • 3B2OF3• 3.5H2OF. Dit materiaal kan worden gebruikt als een vlamvertragend additief in polymeren, hout en textiel.
In het herstel van zink van resterende effluenten
Rijke synthetische wateren op zinkionen die worden weggegooid door elektrodepositieprocessen kunnen worden behandeld door gefluïdiseerde bedtechnologie met behulp van natriumcarbonaat om ZnCo te neerslachten3.
Kan u van dienst zijn: secundaire alcohol: wat is, structuur, eigenschappen, gebruikWanneer de Zn neerslaat2+ In de vorm van carbonaat vermindert de concentratie ervan, wordt de verkregen vaste stof gefilterd en kan de wateren veilig worden weggegooid. De Znco3 neerslag is een hoge zuiverheid.
Andere apps
Maakt het mogelijk om andere zinkverbindingen voor te bereiden. Het wordt gebruikt in cosmetica. Het dient als een pigment en wordt gebruikt bij de productie van porselein, keramiek en aardewerk.
Risico's
Znco stofinademing3 Het kan regering, hoest, borst, koorts en zwetende ongemak veroorzaken. De inname veroorzaakt misselijkheid en braken.
Effecten op het milieu
Het belangrijkste risico is het effect op het milieu, dus het moet worden vermeden om hierin te worden verspreid. Het is zeer giftig voor het waterleven met gevolgen die duren in levende organismen.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Zinkcarbonaat. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Sharma, V. et al. (2018). Synthese van zinkcarbonaat nanonoedles, tot potentiële vlamvertragende voor katoentextiel. Cellulose 25, 6191-6205 (2018). Link hersteld.Springer.com.
- Guan, en. et al. (2020). Colloïdale ZnCo3 als een krachtig depressief van arsenopyriet in zwak alkalische pulp en het interactiemechanisme. Mineralen 2020, 10, 315. MDPI hersteld.com.
- Ziekten van de huid, oog, conjunctiva en extern oor. (2017). In Veterinary Medicine (elfde editie). Hersteld van Scientedirect.com.
- Hannig, m. en Hannig, c. (2013). Nanobiomaterialen in preventieve tandheelkunde. In nanobiomaterialen in klinische tandheelkunde. Hoofdstuk 8. Hersteld van Scientedirect.com.
- Tugrul, n. et al. (2015). Synthese van hydrofobe nanostructuren zinkleningen uit zinkcarbonaat en karakterisering van het product. Res Chem Intermediate (2015) 41: 4395-4403. Link hersteld.Springer.com.
- Luna, m.D.G., et al. (2020). Herstel van zinkkorrels uit synthetisch elektroplerend afvalwater met behulp van een gefluidiseerd kokhomogeen kristallisatieproces. Inteken. J. Omgeving. Sci. Technol. 17, 129-142 (2020). Link hersteld.Springer.com.
- « Specifieke en universele stellingen kenmerken
- Wat is het economische proces? Fasen en voorbeelden »

