Natriumcarbonaat (NA2CO3)
- 3074
- 516
- James Dach
We leggen uit wat natriumcarbonaat, de fysische en chemische eigenschappen, structuur en toepassingen zijn
 Natriumcarbonaatstructuur en formule
Natriumcarbonaatstructuur en formule Wat is natriumcarbonaat?
Hij natriumcarbonaat (NA2CO3) Het is een anorganisch zout, alkalisch metaal en koolzuur. Hij is ook wereldwijd bekend als Sosa Ash. Meren en vulkanische activiteiten verrijkten de bodem van natrium, waarvan de planten werden gevoed; Dan, na een brand, verspreiden deze planten de carbonaatas.
Hoe ontstaat dit metalen natriumzout? Het pure natrium heeft een Valencia -configuratie [NE] 3s1. Het 3s orbitale elektron1 Het wordt gemakkelijk losgemaakt door andere elementen van de natuur (zoals zwavel, zuurstof, chloor, fluor, enz.), het vormen van minerale verbindingen waar de stabiele ionen na deelnemen+.
Dan een+ Het gaat vergezeld van andere ionische soorten in deze vaste stoffen; Hiervan is natriumcarbonaat slechts één meer aanwezig in de natuur. Sindsdien heeft het gedurende de tijd in alle beschavingen gebruikt. Deze beschavingen vonden in die zin dat grijze stof nuttige eigenschappen voor hun huizen en mensen.
Deze eigenschappen markeerden hun gebruik, die tegenwoordig traditionele aspecten uit het verleden handhaven, en anderen voldoen aan de huidige behoeften.
Natriumcarbonaat is zeer overvloedig van aard, en misschien ook in andere gebieden buiten de planeet Aarde, zoals sommige manen van het zonnestelsel.
Formule
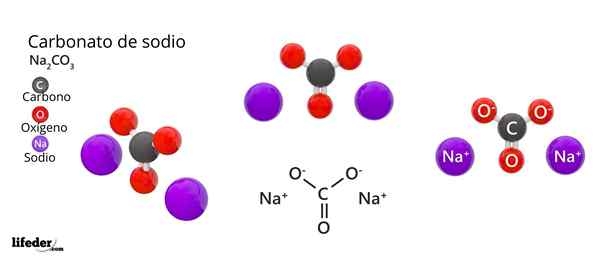
De chemische formule van natriumcarbonaat is NA2CO3. Hoe wordt het geïnterpreteerd? Het betekent dat, in de kristallijne vaste stof, voor elke co -ion32- Er zijn twee na ionen+.
Natriumcarbonaatstructuur
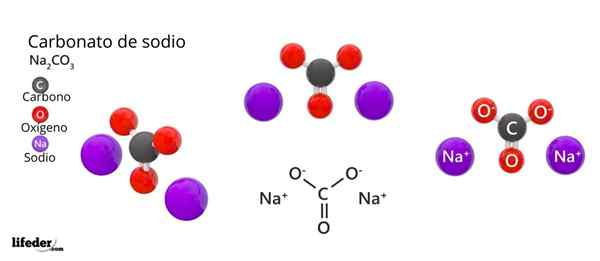
In het bovenste beeld wordt de structuur van de NA weergegeven2CO3 Anhydride (ook wel Sosa Calcinada genoemd). Paarse bollen komen overeen met naionen+, terwijl zwart en rood naar de ionen co32-.
Carbonaationen hebben een platte trigonale structuur, met zuurstofatomen op hun hoekpunten.
Het kan u van dienst zijn: Cinaminezuur: structuur, eigenschappen, verkrijgen, gebruikenHet beeld geeft een panorama gezien vanuit een hoger vlak. Na ionen+ Ze zijn omgeven door zes zuurstofatomen, van co -ionen32-. Dat wil zeggen in de NA2CO3 Anhydride De natrium ontmoet een octaëdrische coördinatie -geometrie (deze is opgesloten in het midden van een octaëder).
Deze structuur is echter ook in staat om watermoleculen te huisvesten, interactie met waterstofbruggen met de hoekpunten van de driehoeken.
NA hydrateert in feite2CO3 (NA2CO3· 10h2Of, na2CO3· 7h2Of, na2CO3· H2Of, en anderen) zijn van grotere overvloed dan anhydridzout.
De thermonatriet (na2CO3· H2O), de natron (na2CO3· 10h2O) en de trona (na3(HCO3)(CO3) · 2H2Of zijn de belangrijkste natuurlijke bronnen van natriumcarbonaat, vooral het trona -mineraal, weergegeven in het eerste beeld.
Gebruik/toepassingen van natriumcarbonaat
Natriumcarbonaat vervult talloze functies bij mensen, huishoudens en industrie, onder deze functies valt het volgende op:
- Natriumcarbonaat wordt gebruikt in tal van reinigingsproducten. Dit komt door zijn desinfecterende capaciteit, zijn kracht om vetten en hun eigendom op te lossen om water te verzachten. Het maakt deel uit van wasmiddelen die worden gebruikt in wasseries, automatische vaatwasser, schoon glas, roerende vlekken, tribunes, etc.
- Carbonaatdesinfectiemiddel kan worden gebruikt op niet -geroeste harde oppervlakken, zoals vloeren, muren, porselein en badkuipen, met uitzondering van de Glasvezel en aluminium, die door hem kunnen worden bekrast.
- Het wordt in sommige voedingsmiddelen gebruikt om de cupcase te vermijden die hierin kan optreden.
- Het is aanwezig in verschillende producten voor persoonlijke verzorging, zoals bellenbaden, tandheelkundige pasta en zeep.
- Het wordt gebruikt in de glasindustrie vanwege het vermogen om silicaten af te breken.
- Het wordt gebruikt bij het onderhoud van de zwembaden, waar het een ontsmettingsmiddel en regelgevingsfunctie van de pH vervult.
- Bij mensen die therapeutisch worden gebruikt bij de behandeling van zuurgraad en dermatitis.
- In de diergeneeskunde wordt het gebruikt bij de behandeling van ringworm en huidreiniging.
Natriumcarbonaatsynthese

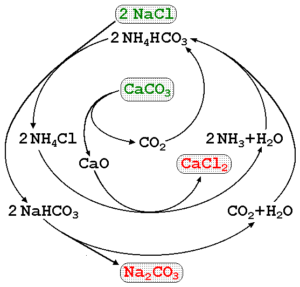
Natriumcarbonaat kan worden vervaardigd met behulp van pekel van de zeeën en kalksteen (Caco3) In het Solvay -proces. In het superieure beeld wordt een procesdiagram geïllustreerd dat wijst op de productieroutes, evenals de reagentia, intermediairs en producten. De reagentia zijn geschreven met groene letters en de producten met rode letters.
De monitoring van deze reacties kan een beetje ingewikkeld zijn, maar de globale vergelijking die alleen de reagentia en producten aangeeft, is:
2NACL (aq) + caco3(s) NA2CO3(s) + cacl2(AC)
De caco3 Het heeft een zeer stabiele kristallijne structuur, dus het vereist constant veel energie om het in CO te ontbinden2. Bovendien genereert dit proces grote hoeveelheden CACL2 (calciumchloride) en andere onzuiverheden, wiens lozingen de kwaliteit van water en het milieu beïnvloeden.
Er zijn ook andere methoden voor de productie van natriumcarbonaat in industriële velden, zoals Hou- en LeBlanc -processen.
Tegenwoordig is het verkrijgen van zijn natuurlijke mineralen duurzaam, de trona is de meest voorkomende hiervan.
Aan de andere kant bestond de meest traditionele methode uit de teelt en het verbranden van planten en algen die rijk zijn aan natrium. Toen baadden de as met water en onderworpen aan verwarming tot het product. Vanaf hier kwam de beroemde as van Sosa tevoorschijn.
Natriumcarbonaateigenschappen
Dan een2CO3 Het is een hygroscopisch witte vaste stof, toilet, met een molecuulgewicht van 106 g/mol en een dichtheid van 2,54 g/ml bij 25 ° C.
De eigenschappen veranderen als een watermolecuul opneemt in zijn kristallijne structuur. Omdat water waterstofbruggen kan vormen en de ionen "open ruimte" ertussen, neemt het volume van het glas toe en neemt de dichtheid van het hydraat af. Bijvoorbeeld voor NA2CO3· 10h2Of de dichtheid is 1,46 g/ml.
Kan u van dienst zijn: omkeerbare reactie: kenmerken en voorbeeldenDan een2CO3 Smelt bij 851 ºC, ontleden volgens de volgende vergelijking:
NA2CO3(s) => na2Of (s) + co2(G)
Nogmaals, ondanks de co -ionen32- en NA+ Ze verschillen in maten, hun elektrostatische interacties zijn zeer efficiënt en behouden een stabiel kristallijn netwerk.
Watermoleculen "belemmeren" deze interacties en als gevolg daarvan zijn hydraten gevoeliger voor ontbinden dan anhydride.
Het is een basiszout; dat wil zeggen, opgelost in water genereert een oplossing met een pH groter dan 7. Dit komt door de hydrolyse van CO32-, wiens reactie oh vrijgeeft- middenin:
CO32-(AC) + H2Of (l) hco3-(AC) + OH-(AC)
Het is zeer oplosbaar in water- en polaire oplosmiddelen, zoals glycerol, glycerine, aceton, acetaten en vloeibare ammoniak.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. In elementen van groep 1. (Vierde druk., P. 265). MC Graw Hill.
- Schuin.borg. (2018). Natriumwaterstofcarbonaat en natriumcarbonaat. Hersteld van Scifun.borg
- Wikipedia. (2018). Natriumcarbonaat. Opgehaald van.Wikipedia.borg
- Pubchem. (2018). Natriumcarbonaat. Hersteld van PubChem.NCBI.NLM.NIH.Gov
- Ciner Resources Corporation. (2018). Natriumcarbonaat. Ciner hersteld.ons.com
- Peltier K. (3 juli 2018). Alles wat u moet weten over natriumcarbonite. Ontvangen op 8 april 2018, van: TheSpruce.com
- Netto -industrie. (2018). Natriumcarbonaat - Gebruik van natriumcarbonaat. Ontvangen op 8 april 2018, van: Science.spoed.borg

