Lithiumcarbonaat (Li2CO3) structuur, eigenschappen, gebruik

- 3743
- 855
- Alton D'Amore
Hij lithiumcarbonaat Het is een anorganische vaste stof gevormd door twee lithium li+ en een carbonaatanion CO32-. De chemische formule is li2CO3. De li2CO3 Het is een witte kristallijne vaste stof die kan worden verkregen door de reactie tussen lithiumhydroxide en koolstofdioxide.
Lithiumcarbonaat heeft een zeer hoog fusiepunt, dus het wordt gebruikt bij de bereiding van glas, keramiek en porselein. Het heeft zeer gevarieerd gebruik, zoals oplaadbare lithiumbatterijen, bij het bereiden van andere lithiumverbindingen, laselektroden en in schilderijen en vernissen.
 Lithium carbonaat li2CO3 stevig. Afbeelding gemaakt door W: Gebruiker: Walkerma in juni 2005. Bron: Wikimedia Commons.
Lithium carbonaat li2CO3 stevig. Afbeelding gemaakt door W: Gebruiker: Walkerma in juni 2005. Bron: Wikimedia Commons. Li wordt ook gebruikt2CO3 In cementmengsels om snelle setting en aluminiumproductie te bereiken.
Een van het belangrijkste gebruik is bij de behandeling van sommige psychische aandoeningen zoals depressie en overmatig agressief gedrag, onder andere,.
Het gebruik ervan als medicijn moet echter naar behoren worden gecontroleerd door medische specialisten omdat mensen die met li worden behandeld2CO3 Ze kunnen schadelijke effecten hebben voor de gezondheid, zoals hypothyreoïdie (verminderde functie van de schildklier).
[TOC]
Structuur
Lithiumcarbonaat bestaat uit twee lithium li+ en een carbonaatanion CO32-.
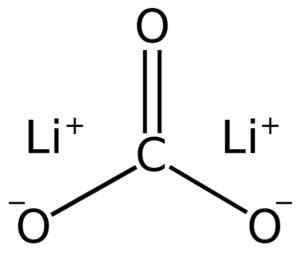 LII lithiumcarbonaatstructuur2CO3. Adrian Hands [Public Domain]. Bron: Wikimedia Commons.
LII lithiumcarbonaatstructuur2CO3. Adrian Hands [Public Domain]. Bron: Wikimedia Commons. Elektronische lithiumconfiguratie in oxidatietoestand +1 is 1s2 2s0, Nou, hij heeft het elektron van de laatste laag verloren, waardoor hij stabieler is. De carbonaat ion co32- Het heeft een vlakke structuur.
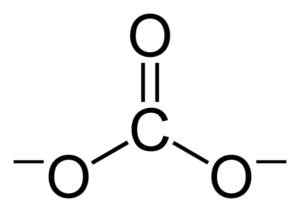 Vlakke structuur van de Coal Ion Co32-. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Vlakke structuur van de Coal Ion Co32-. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Negatieve belastingen worden gelijk verdeeld over de drie zuurstofatomen van de Coal Ion Co32-.
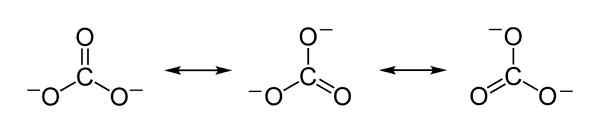 Theoretische resonantiestructuren van de carbonaationen CO32- die dienen om de billijke verdeling van negatieve belastingen tussen de 3 zuurstofatomen te verklaren. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Theoretische resonantiestructuren van de carbonaationen CO32- die dienen om de billijke verdeling van negatieve belastingen tussen de 3 zuurstofatomen te verklaren. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
-Lithiumcarbonaat
-Dilitio carbonaat
Fysieke eigenschappen
Fysieke staat
Kristallijne witte vaste stof van monokliene structuur
Molecuulgewicht
73,9 g/mol
Smeltpunt
723 ºC
Ontleding
Het ontleedt bij 1300 ºC.
Dikte
2.11 g/cm3
Oplosbaarheid
Weinig oplosbaar in water: 1,31 % per gewicht bij 20 ºC. De oplosbaarheid in water neemt af naarmate de temperatuur toeneemt. Het is oplosbaar in verdunde zuren. Het is onoplosbaar in alcohol en aceton.
Kan u van dienst zijn: bariumoxide (BAO): structuur, eigenschappen, gebruik, risico'spH
Wateroplossingen zijn alkalisch, ze hebben een pH groter dan 7.
Chemische eigenschappen
De li2CO3 Het wordt gehydrolyseerd in waterige oplossing die een basisoplossing genereert. Het kleine deel van de verbinding dat in water wordt opgelost, laat het carbonaatanion co -vrij maken32-.
The Carbonate Anion Co32- Vrij in waterige oplossing neemt een proton om het HCO -bicarbonaatanion te vormen3-, Zoals te zien is in de volgende reactie:
CO32- + H2O → HCO3- + Oh-
De aanwezigheid van oh ionen- Het is wat de oplossing basic maakt.
Biologische eigenschappen
In dierlijke en menselijke weefsels zijn er normaal gesproken lithium -ionsporen, maar tot het moment is er geen natuurlijke fysiologische rol van dit ion bekend.
In het menselijk organisme de li2CO3 Innam als medicatie werkt op verschillende signaalmechanismen in neuronen en andere cellen. Dit is het gevolg van de vervanging van kationen zoals natrium en kalium.
De opname van het lithiumion in de structuur van het celmembraan kan de respons op hormonen en celkoppeling met energieprocessen veranderen.
Op deze manier wijzigt lithium verschillende cellulaire processen, waaronder metabolisme.
Door de wijziging van de manier waarop de cellen werken2CO3 U kunt handelen naar de communicatiemechanismen van neuronen in de hersenen.
Het verkrijgen van
De li2CO3 Het kan worden verkregen door de lithiumhydroxide -reactie met koolstofdioxide CO2, Zoals hieronder getoond:
2 liOH + CO2 → li2CO3 + H2OF
Commercieel treedt commercieel op bij mineralen die lithium bevatten zoals spodumen en lepidoliet. Deze mineralen worden behandeld bij hoge temperaturen met bepaalde sulfaatzouten of met alkalische verbindingen om lithiumzouten te verkrijgen.
De verkregen lithiumzouten worden gezuiverd met water- of zure oplossingen en vervolgens worden ze behandeld met carbonaten om LI te vormen2CO3.
Maar de Li2CO3 Op deze manier wordt bereikt met sulfaten of calciumchloriden, magnesium, ijzer, natrium, kalium, enz. Dus vereisen daaropvolgende zuivering.
Toepassingen
Bij de behandeling van psychische aandoeningen
Het wordt gebruikt als een antidepressivum, antimanisch middel, bij de behandeling van agressief-impulsief gedrag en voor bipolaire aandoeningen (mensen die hun humor plotseling zonder reden veranderen, gewelddadig worden).
Kan u van dienst zijn: 20 voorbeelden van chemische sublimatie en kenmerken Sommige agressieve impulsieve aandoeningen kunnen met LI worden behandeld2CO3. Auteur: Prawny. Bron: Pixabay.
Sommige agressieve impulsieve aandoeningen kunnen met LI worden behandeld2CO3. Auteur: Prawny. Bron: Pixabay. Artsen hebben opgemerkt dat hun toediening leidt tot de afname van de intensiteit en frequentie van ernstige periodes van depressie en manische afleveringen.
Het wordt alleen gebruikt, dat wil zeggen zonder enige toegevoegde verbinding, in de onderhoudstherapie van unipolaire depressie en voor schizoecifical stoornis. Het dient ook om het antidepressiva -effect van andere medicijnen te vergroten.
Hoewel het is gebruikt om kinderen te behandelen met schijnbare symptomen van bipolaire stoornis en hyperactiviteit met neurotische of agressieve componenten, is het in alle gevallen niet effectief geweest.
Bij de behandeling van symptomen van andere ziekten
Het wordt gebruikt om de frequentie van sterke hoofdpijn, terugkerend en chronisch te verminderen.
Het wordt gebruikt om de incidentie van infectie te verminderen bij patiënten met door chemotherapie geïnduceerde neutropenie of andere redenen. Neutropenie is de afname van neutrofielen, een soort witte bloedcellen die helpen bij het bestrijden van infecties in het lichaam.
Het is gebruikt als een schildklier -enzymremmer voor de behandeling van hyperthyreoïdie, maar het is geen voorkeursbehandeling vanwege de nadelige effecten.
Vorm van administratie
Het wordt gebruikt in de vorm van LI -tabletten of capsules2CO3. Ook in trage -release tabletten met lithiumcitraat. Li heeft de voorkeur2CO3 Omdat het de keel niet irriteert bij het doorslikken, zoals het gebeurt met andere lithiumzouten.
 Auteur: Pete Lyforth. Bron: Pixabay.
Auteur: Pete Lyforth. Bron: Pixabay. Bijwerkingen
De li2CO3 Het kan een schadelijk effect hebben op schildklier en nieren, dus de functie van deze organen moet worden gecontroleerd vóór en tijdens de behandeling met deze verbinding.
De li2CO3 Het kan giftig zijn in concentraties die zeer dicht bij die in medische behandelingen worden gebruikt, dus een continue evaluatie van hun bloedserumwaarden is vereist.
LI -vergiftigingssymptomen2CO3 Het zijn trillingen, spierspasmen, spierzwakte, diarree, braken, slaperigheid of ataxie (achteruitgang bij spiercoördinatie), onder andere.
Aan het begin van de lirapie2CO3 Symptomen zoals trillingen, hoofdpijn en misselijkheid kunnen ook optreden. Maar deze hebben de neiging om te verdwijnen door doorgaan met medicijnen.
Kan u van dienst zijn: HolmioDe meeste behandelde mensen kunnen ook leukocytose ontwikkelen (toename van het aantal witte bloedcellen), maar dit is omkeerbaar.
Mensen die medicijnen worden met Li2CO3 Ze mogen geen voertuigen afhandelen of machines bedienen, omdat het de fysieke coördinatie vermindert en de mogelijkheid om activiteiten uit te voeren die alert moeten zijn.
Gevallen waarin het niet mag worden toegediend
Het moet niet worden gebruikt bij kinderen jonger dan 12 jaar, omdat het de vorming van botten en hun dichtheid kan verstoren, omdat het de concentraties van een schildklierhormoon verandert. Het heeft ook de neiging om de plaats van calcium in de botten te bezetten.
Ze mogen niet worden behandeld met Li2CO3 Mensen met hart- en vaatziekten, nieren of schildklier. Noch bij ernstig uitgedroogde patiënten.
Zwangere vrouwen mogen niet worden toegediend, vooral tijdens het eerste trimester van de zwangerschap. Lithium kruist de placenta en kan de foetus gemakkelijk bereiken met mogelijke teratogene effecten, dat wil zeggen, het kan afwijkingen of misvormingen produceren bij de baby die brouwt.
Oudere mensen die behandeling nodig hebben met Li2CO3 Ze moeten met grote zorg worden behandeld en met doses lager dan die van jonge volwassenen, omdat ze hypothyreoïdie -ziekte kunnen ontwikkelen.
Andere gebruiken
De li2CO3 Hoge zuiverheid wordt veel gebruikt bij de productie van lithium oplaadbare batterijen.
Het wordt gebruikt in gesmolten carbonaatbrandstofcellen.
Het wordt gebruikt bij de productie van elektrisch porselein dat een soort elektriciteits isoleert porselein. Het wordt ook gebruikt bij de productie van beglazing op keramiek.
 De li2CO3 Het wordt gebruikt om elektrisch porselein te maken, dat wordt gebruikt als een elektriciteitsisolator, bijvoorbeeld in elektrische stroompalen. FIR0002 Flagstoffotos [AT] Gmail.com Canon 20d + tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/licenties/oude licenties/FDL-1.2.html)]. Bron: Wikimedia Commons.
De li2CO3 Het wordt gebruikt om elektrisch porselein te maken, dat wordt gebruikt als een elektriciteitsisolator, bijvoorbeeld in elektrische stroompalen. FIR0002 Flagstoffotos [AT] Gmail.com Canon 20d + tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/licenties/oude licenties/FDL-1.2.html)]. Bron: Wikimedia Commons. Het maakt het mogelijk om keramiek te bereiden met lage expansiecoëfficiënt, dat wil zeggen dat het zeer weinig uitbreidt bij het verhogen van de temperatuur, zodat het keramiek kan worden gebruikt in een hogere temperatuurinterval.
Andere van zijn toepassingen zijn als een katalysator, bij de vervaardiging van andere lithiumverbindingen, zoals laselektroden, in luminescerende verfformules, vernissen en kleurstoffen, evenals in aluminium elektrolytische productie.
Het is handig voor het genereren van snellere cementinstelling en draagt bij aan tegellijm zodat ze in korte tijd kunnen worden vastgesteld.
 Auteur: Capri23Auto. Bron: Pixabay.
Auteur: Capri23Auto. Bron: Pixabay. Referenties
- Cai, W. et al. (2018). Verwijdering van SO42- van li2CO3 door herkristallisatie in NA2CO3. Kristallen 2018, 8, 19. MDPI hersteld.com.
- Gadikota, g. (2017). Het verbinden van de morfologische en kristalstructurele veranderingen tijdens de omzetting van lithiumhydroxidemonohydraat met lithiumcarbonaat met behulp van multi-schalige röntgenverstrooiingsmetingen. Mineralen 2017, 7, 169. MDPI hersteld.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Lithiumcarbonaat. Hersteld van: pubchem.NCBI.NLM.NIH.Gov.
- Kirk-othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. VCH VerlagSgellschaft MBH.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- « Interne en externe geconjugeerde hoeken voorbeelden, oefeningen
- .Stearinezuur (CH3 (CH2) 16COOH) structuur, eigenschappen, gebruik »

