Calciumcarbonaatstructuur, eigenschappen, vorming, gebruik

- 4957
- 1123
- Miss Herman Russel
Hij calciumcarbonaat Het is een anorganische verbinding waarvan de chemische formule caco is3. Het wordt voornamelijk gevonden in mineralen zoals calciet en aragonite. Evenzo componeert de kalksteen, een sedimentair gesteente waarin het Calcita -mineraal aanwezig is.
Dit belangrijke metaalcarbonaat wordt industrieel verkregen door extractie en slijpen van de mineralen die het bevatten; Hiertoe wordt marmer voornamelijk gebruikt. Een ander proces ligt in het gebruik van calciumoxide, dat calciumhydroxide wordt, die calciumcarbonaat neerslaat door de toevoeging van koolstofdioxide. Op deze manier worden kristallen verkregen uit een breed scala van maten.
 De slakkenhaal bestaat voornamelijk uit calciumcarbonaat. Bron: Pixabay.
De slakkenhaal bestaat voornamelijk uit calciumcarbonaat. Bron: Pixabay. Ze kunnen ook worden gebruikt voor de industriële productie van caco3, In kleine schaal, de schelpen van de kokkels, de eierschalen en de oesterschelpen waarin deze aanwezig is.
Calciumcarbonaat aanwezig in kalksteen wordt opgelost door koolstofdioxide in water, waardoor calciumbicarbonaat wordt gegenereerd. Deze actie kan de grotten veroorzaken en is een oorzaak van de alkalinatie van water; gebeurtenis van groot belang bij het onderhoud van het leven erin.
Het is gebruikt bij de constructie en uitwerking van sculpturen; Voorbeelden hiervan zijn de partner van Athene, de kathedraal van Krakow en het sculptuur van Abraham Lincoln in Washington. De gevoeligheid ervan voor zure regen heeft echter het gebruik in de constructie verminderd.
Calciumcarbonaat heeft meerdere toepassingen in de industrie gehad als een plastic en papiervulmateriaal. In de geneeskunde is het gebruikt om de zuurgraad van de maag te regelen; als calciumsupplement in de voeding; om fosfatie te beheersen bij patiënten met chronisch nierfalen, enz.
[TOC]
Structuur
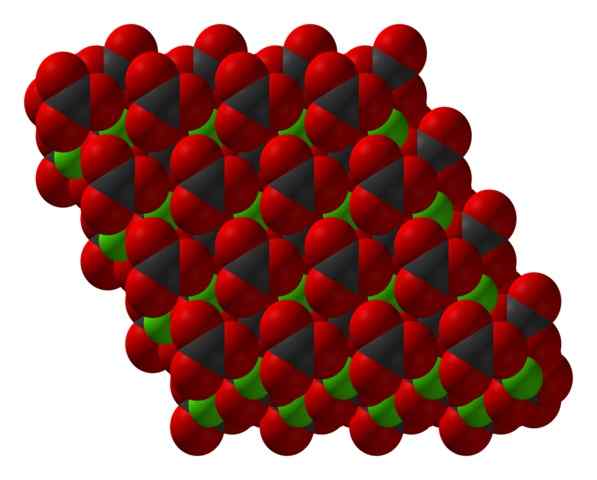 Chanco3 kristallijne structuur weergegeven met een ruimtevulmodel. Bron: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Chanco3 kristallijne structuur weergegeven met een ruimtevulmodel. Bron: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] De calciumcarbonaatformule, caco3, geeft aan dat het aandeel tussen ca -ionen2+ en co32- Het is 1: 1; Dat wil zeggen, voor elke CA2+ Er is een CO32- van tegenhanger die elektrostátisch met hem in wisselwerking staat. Aldus heeft de ionische binding uiteindelijk deze ionen om structurele patronen te vormen die een kristal definiëren.
In het superieure beeld wordt de structuur van de caco getoond3. Groene bollen komen overeen met cations2+, en de rode en zwarte bollen van de co -anionen32-. Merk op dat de structuur lijkt te worden gevormd door meerdere lagen: een van calcium en een andere carbonaat; wat betekent dat dat kristalliseert in een compacte zeshoekige structuur.
Het kan u van dienst zijn: ammoniumchloride (NH4CL)Deze zeshoekige fase (β-caco3) Komt overeen met een polymorf. Er zijn twee anderen: ortorrombic (λ-caco3) en een zelfs dichtste zeshoekige (μ-caco3)). Het lagere beeld helpt om de gelukkige zeshoek beter te visualiseren:
 Zeshoekige structuur van calciet. Materiaalwetenschapper bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Zeshoekige structuur van calciet. Materiaalwetenschapper bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Afhankelijk van de temperatuur (en voor dit zout de druk) worden de ionen in hun trillingen echter aangepast aan andere structuren; Dit zijn de bovengenoemde polymorfen (β, λ en μ).
Omdat ze klinken, zijn ze niet goed bekend, tenzij ze in een volgende sectie met hun mineralogische namen worden genoemd.
Eiwithardheid
Caco's kristallen3 Ze zijn niet alleen: ze kunnen onzuiverheden organiseren zoals andere metalen kationen die ze in kleuren verven; O eiwitten, met een organische matrix die op de een of andere manier bijdraagt aan zijn natuurlijke hardheid.
Eiwitten verminderen de spanning die door kristallen van elkaar wordt ervaren vóór een druk of impact. Als? Bij het afwijzen tussen de kristallen, werkend alsof het een "pad" is (vergelijkbaar met de bakstenen cement-lady).
Dat is de reden waarom deze verbinding of mineraal biocompatibel is en het is niet verbaasd dat het deel uitmaakt van de nagels, mariene schelpen, schelpen of botten van de egels. Het is een bron van inspiratie geweest voor degenen die zich toeleggen op het ontwikkelen van nieuwe materialen.
Eigenschappen
Andere namen
-Aragoniet
-Calcito
-Wielend
-Calciummelk
-Whiteboard
-Marmer
Molaire massa
100.086 g/mol.
Fysieke beschrijving
Wit stof toilet.
Smaak
Vergelijkbaar met krijt, smakeloos.
Fusie- en kookpunten
Het breekt af omdat het CO vrijgeeft2 Voordat u zelfs smelt of kookt.
Oplosbaarheid
Praktisch onoplosbaar in water en alcohol. Het wordt opgelost met bruisende beurzen bij verdunde azijnzuur en zoutzuurzuren. Hydroxiden verminderen echter hun oplosbaarheid. Ondertussen verhogen ammoniumzouten en koolstofdioxide de oplosbaarheid van calciumcarbonaat in water.
Dikte
2.7 tot 2,95 g/cm3.
Ontleding
Ongeveer 825 ºC wordt onderverdeeld in calciumoxide (kalk) en koolstofdioxide (CO2)).
pH
8 tot 9
Brekingsindex
-1.7216 tot 300 nm en 1.6584 tot 589 nm (Calcita).
-1.5145 tot 300 nm en 1.4864 tot 589 nm (aragonite).
Onverenigbaarheden
Met zuren, aluminium en ammoniumzouten.
Fusion Enthalpy
36 kJ/mol bij 800 ºC (calciet).
Kan u dienen: Molariteit: concentratie, eenheden, berekening, oefeningenOplosbaarheid Product constant
3.36 · 10-9 bij 25 ºC.
Hardheid
-3.0 (calciet)
-3.5 - 4.0 (aragonite) op de mohs -schaal.
Faseovergangen
Het aragoniet is metastabiel en verandert onomkeerbaar in calciet wanneer het het in droge lucht verwarmt tot 400 ºC.
Reactiviteit
Calciumcarbonaat reageert met zuren, het vrijgeven van koolstofdioxide, ionisch calcium en water.
Calciumcarbonaat wordt gecombineerd met verzadigd water met koolstofdioxide, equivalent aan carbonzuur (h2CO3), Om calciumbicarbonaat te vormen.
Opleiding
Het krijt, marmer en kalksteen, de eerste twee mineralen en een rotsachtig materiaal de derde, bevatten calciumcarbonaat en zijn van sedimentaire oorsprong, ze worden gedacht door de sedimentatie van slakken gedurende miljoenen jaren van jaren.
De pH kan de belangrijkste factor zijn bij de vorming van polymorfen bij een temperatuur van 24 ° C. De Vaterita is het belangrijkste product in een pH -bereik tussen 8,5 en 10; Aragonite is pH 11; en het calciet tot pH> 12.
Het is ook bekend dat veel zoetwateralgen calcietkristallen bouwen wanneer ze groeien in een calciumverzadigde omgeving. Bovendien kunnen microalgen calciumcarbonaatprecipitatie veroorzaken.
Calciumcarbonaatvormen
In de onderstaande afbeeldingen worden de drie hoofdvormen of polymorfen getoond voor calciumcarbonaat:
 Calcita kristal. Bron: Parent Géry [Public Domain]
Calcita kristal. Bron: Parent Géry [Public Domain] Aragonite Crystal. Bron: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Aragonite Crystal. Bron: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Vaterita -kristallen. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Vaterita -kristallen. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Van boven naar beneden zijn het calciet-, aragoniet- en vaterita -polymorfen. Let op het verschil tussen de morfologie van hun kristallen (de kleur is typerend voor zijn oorsprong en kenmerken van zijn omgevingen).
De vaterita is ondoorzichtig dan het calciet, de laatste wordt zelfs compleet. Ondertussen lijken de aragonietkristallen op kleine langwerpige monolieten.
Als monsters van deze drie polymorfen worden waargenomen onder de elektronische microscoop, hun kristallen (van grijsachtige tonen omdat de techniek geen kleurresolutie toestaat), zouden dezelfde morfologie worden gevonden als in macroscopische schalen; dat wil zeggen op het eerste gezicht.
Onder deze drie polymorfen is het calciet het meest voorkomende en stabiel, gevolgd door het aragoniet, en ten slotte de vaterita, de zeldzaamste van de vormen van de caco3
Kan u van dienst zijn: calorimetrie: welke studies en toepassingenToepassingen
Industriëlen
Calciumcarbonaat verhoogt de weerstand tegen torsie en tractie van synthetisch en natuurlijk rubber, waardoor de flexibiliteit wordt gehandhaafd. Het wordt in de bouwsector gebruikt als cementingrediënt en als een grondstof voor kalk. Het gebruik ervan is verminderd omdat het wordt beschadigd door zure regen.
Calciumcarbonaat wordt gebruikt bij ijzerzuivering. In de vorm van kalk elimineert het zwaveldioxide aanwezig in het metaal. Beersuikerzuivering wordt gebruikt. Het werd gebruikt als krijt voor leisteen, maar is vervangen door het gips voor deze toepassing.
Calciumcarbonaat wordt gemengd met de stopverf die wordt gebruikt bij de plaatsing van glas. Grond wordt gebruikt als vulmateriaal in de microporeuze film die in luiers wordt gebruikt. Het wordt ook gebruikt als vulmateriaal in kunststoffen zoals PVC. Bovendien neemt de sterkte van plastic toe.
Calciumcarbonaat wordt gebruikt om de dekkingscapaciteit van de schilderijen te vergroten. Het wordt gebruikt als papiervulmateriaal omdat het goedkoper is dan houtvezel, die meer dan 10% van het papier kan vertegenwoordigen.
Artsen
Het wordt gebruikt als een antacida om maaghyperaciditeit te bestrijden en indigestie te verlichten. Het wordt gebruikt als een calciumsupplement in de voeding en bij de behandeling en preventie van osteoporose. Het wordt gebruikt bij de behandeling van hyperfosfatie bij patiënten met chronisch nierfalen.
Het is gebruikt om de ongewenste effecten van proteaseremmers te verminderen die worden gebruikt bij de behandeling van HIV, waarmee bij patiënten een vermindering van diarree wordt geobserveerd.
Het produceert een afname van de bloeddruk bij zwangere vrouwen met hypertensie en pre -eclampsie, omdat beide kunnen worden geassocieerd met een toename van de calciumvraag als gevolg van foetale aanwezigheid.
Anderen
Calciumcarbonaat wordt in de landbouw gebruikt als meststoffen en om de zuurgraad van de grond te bestrijden. Het wordt gebruikt als een conserveermiddel, kleurhoudende en herbevestiging van voedsel.
Bovendien is het een ingrediënt van tandpasta en dient het als schurend in stof bij het schoonmaken en wassen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Carbonaatcalcium. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Carbonaatcalcium. PubChem -database., CID = 10112. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Kai-yin Chong, Chin-Hua Chia en Sarani Zakaria. (2014). Polymorfen calciumcarbonaat op temperatuurreactie. AIP Conference Proceedings 1614, 52; doen.org/10.1063/1.4895169
- Greg Watry. (1 november 2016). Ontdekken hoe carbonaatkristallen kracht krijgen. Voordeel zakelijke marketing. Hersteld van: RDMAG.com
- Amerikaanse elementen. (2019). Carbonaatcalcium. Opgehaald uit: Amerikaan.com
- Elsevier. (2019). Carbonaatcalcium. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Chemisch boek. (2017). Carbonaatcalcium. Hersteld van: chemisch boek.com

