Carbocatie -vorming, kenmerken, typen, stabiliteit
- 3673
- 1097
- Ernesto McKenzie
A carbocatie, Zoals de naam al aangeeft, is het een organisch ion met een positief geladen koolstofatoom, dat wordt gekenmerkt door zeer onstabiel te zijn, voor een korte tijd bestaan. Het is meestal een intermediair in organische reacties, dat wil zeggen, het is ontstaan als onmisbare stappen van de respectieve moleculaire mechanismen.
Historisch gezien zijn er conflictpunten geweest in de compressie van wat carbocatie is. Dit komt omdat er symfines van reactieve moleculen zijn die om de een of andere reden een positieve belasting krijgen in een van hun koolstofatomen. Klassieke carbocatie, om zo te zeggen, is er een die kan worden weergegeven door de algemene formule van de onderstaande afbeelding.
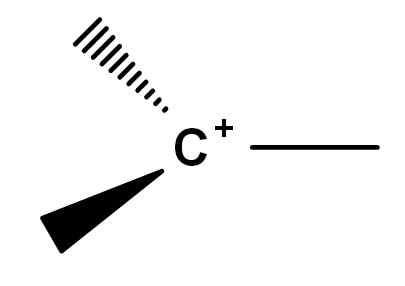 Algemene formule van een carbocatie. Bron: Gabriel Bolívar.
Algemene formule van een carbocatie. Bron: Gabriel Bolívar. Merk op hoe de positieve belasting zich exact op het koolstofatoom bevindt en ook een link mist. Daarom is carbocatie slechte elektronen, dit is de oorzaak van zijn hoge reactiviteit.
Stel dat methaan, cho4. Als koolstof een van zijn waterstofatomen zou verliezen, zouden we een van de vier C-H-bindingen elimineren. Dan ontstond de methylcarbocatie, CH3+, die we kunnen vertegenwoordigen door de waterstofatomen aan de uiteinden van de strepen van de bovenste formule te plaatsen. De ch3+ Het is de eenvoudigste van alle carbocaties.
[TOC]
Opleiding
Hoe worden carbocaties gevormd? Het antwoord wordt gevonden in reactiesmechanismen. Het overgrote deel van de meerderheid is echter een van de volgende twee aspecten gemeen:
-Heterolytische breuk
-Toevoeging van elektronen π aan een elektrofiel
Heterolytische breuk
In de heterolithische breuk de C-G-binding, G is een atoom of groep, deze wordt op een ongelijke manier gebroken: de elektronen van de binding worden g gelaten, terwijl het koolstofatoom een positieve belasting verwerft. Bijvoorbeeld:
Kan u van dienst zijn: arseen: geschiedenis, structuur, eigenschappen, gebruik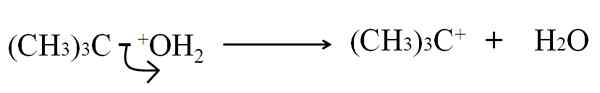 Heterolytische breuk in tertbutanol uitdroging. Bron: Gabriel Bolívar.
Heterolytische breuk in tertbutanol uitdroging. Bron: Gabriel Bolívar. Nu kan deze pauze worden gegeven voor verschillende methoden, die op zijn beurt het mechanisme en de beschouwde reactie zullen veranderen.
Toevoeging van elektronen π aan een elektrofiel
Het andere proces waardoor een carbocatie wordt gevormd, die veel gebruikelijk is in aromatische alkenen en verbindingen, is door elektronen van een dubbele binding aan te vallen aan een elektrofiel. De meest voorkomende gevallen zijn de hydrogenering van alkenen door de werking van een zuur:
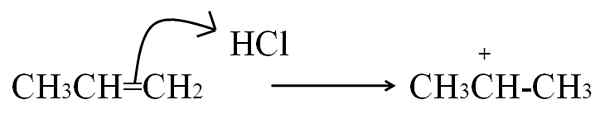 HCL -reactie met de propeno om een carbocatie te vormen als tussenpersoon. Bron: Gabriel Bolívar.
HCL -reactie met de propeno om een carbocatie te vormen als tussenpersoon. Bron: Gabriel Bolívar. Deze vergelijking komt overeen met de vorming van carbocatie, die het is een tussenpersoon, Geen product. De elektronen met dubbele binding vallen HCl -waterstof aan, de elektrofiel. Waterstof wordt aan koolstof aan de rechterkant van de dubbele binding toegevoegd, dus de groep -ch wordt gevormd3, Terwijl de koolstof links de positieve belasting verwerft.
Kenmerken
Hybridisatie
De algemene formule die in het begin wordt gepresenteerd, onthult een trigonale vlakke geometrie rond het koolstofatoom. Dit is te wijten aan de hybridisatie die wordt geleden door koolstofatomaire orbitalen om hybride SP -orbitalen te worden2, die worden gescheiden onder een hoek van 120º. Hoewel het niet wordt weergegeven, heeft carbocatie een orbitaal P Puur en leeg, in staat om elektronen te accepteren.
Zuurgraad
Carbocatie is een zure soort, hetzij volgens de definitie van Brönsted of Lewis. Hun positieve ladingsvraag elektronen of waterstofatomen die worden gegeven. Het is om deze reden dat carbocaties niet in zeer basismedia kunnen worden gevormd, omdat ze onmiddellijk zouden reageren om andere producten te ontstaan.
Stabiliteit
De hybridisatie SP2 van carbocatie maakt het kwetsbaar voor aanvallen van rijke soorten in elektronen. Deze functie wordt verder geaccentueerd door zijn grote zuurgraad. Bijgevolg is carbocatie een zeer reactieve soort, die nauwelijks wordt gevormd en snel (in een kwestie van nanoseconden) reageert om aanleiding te geven tot het ware product van de chemische reactie.
Kan u dienen: sulfaminezuur: structuur, eigenschappen, synthese, gebruikSoorten carbocaties
Er zijn verschillende soorten carbocaties. Deze kunnen echter als volgt worden geclassificeerd:
-Primair
-Ondergeschikt
-Tertiair
-Aromatische of arillos
-Vinyl en alilisch
Primair
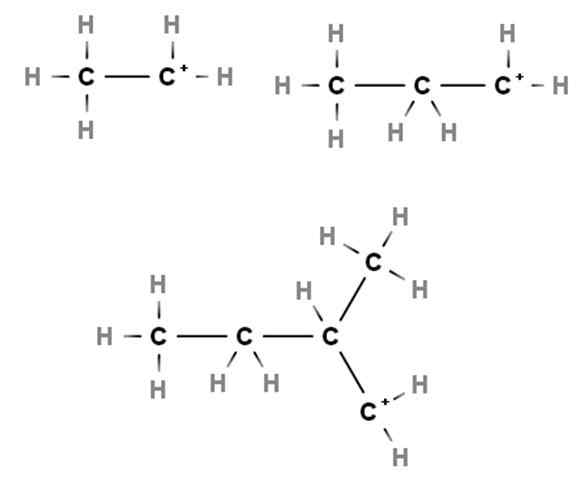 Primaire carbocaties. Bron: Gabriel Bolívar via Molview.
Primaire carbocaties. Bron: Gabriel Bolívar via Molview. Aankomsten tonen voorbeelden van primaire carbocaties. Ze worden dat genoemd omdat de positieve belasting in een primaire koolstof ligt, dus het is alleen gekoppeld aan een koolstofatoom. Etano, ch3Ch3, Wanneer een H zijn doelen verliest, kan carbocatie cho3Ch2+ of +Ch2Ch3.
Ondergeschikt
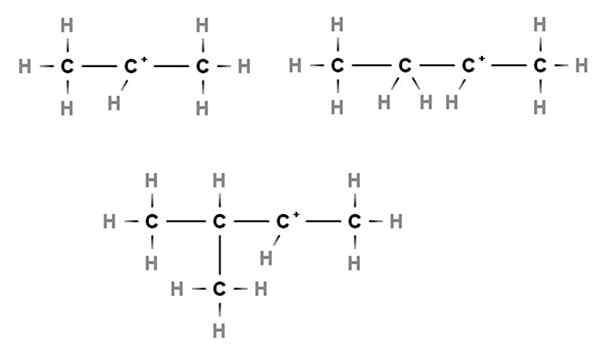 Secundaire carbocaties. Bron: Gabriel Bolívar via Molview.
Secundaire carbocaties. Bron: Gabriel Bolívar via Molview. In secundaire carbocaties bevindt de positieve belasting zich in een secundaire koolstof, 2e, die is gekoppeld aan twee koolstofatomen. Als bijvoorbeeld het propaan, cho3Ch2Ch3, We nemen een H van de centrale koolstof weg, we zullen de carbocatie hebben cho3Ch2+Ch3.
Tertiair
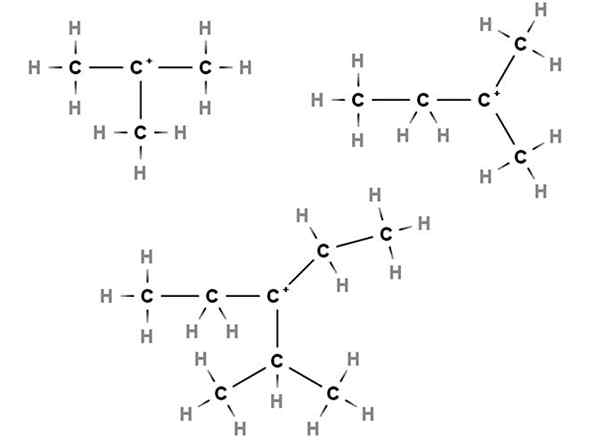 Tertiaire carbocaties. Bron: Gabriel Bolívar via Molview.
Tertiaire carbocaties. Bron: Gabriel Bolívar via Molview. In tertiaire carbocaties bevindt de positieve belasting zich in een tertiaire koolstof, 3e, gekoppeld aan drie koolstofatomen. Merk op dat ze, in tegenstelling tot de eerste twee soorten carbocaties, waterstofatomen missen.
We hebben dus methylpropaan of isobutaan, ch (ch (kies3))3, Die door een waterstof te verliezen, de centrale koolstof carbocatie vormt +C (Ch3))3.
Aromatisch
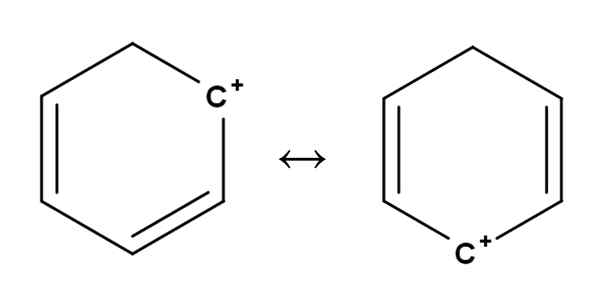 Benzeencarbocat. Bron: Gabriel Bolívar.
Benzeencarbocat. Bron: Gabriel Bolívar. Aromatische of aromatische carbocaties zijn misschien wel de meest special van allemaal. Uw training lijkt erg op die beschreven voor alkenen in het eerste gedeelte.
In hen bevindt de positieve belasting zich in principe in een van de koolstofatomen van een aromatische ring, zoals de benzeen. De positieve belasting is echter niet vast, maar wordt door resonantie in andere ringposities verspreid.
Het kan je van dienst zijn: ribulosa-1,5-biphosfaat (RUBP): kenmerken, carbolixationDit is hoe de positieve belasting, zoals hierboven te zien, van de ene koolstof naar de andere overgaat in de benzeenring. Dit kenmerk geeft deze carbocatie grote stabiliteit tegen de andere soorten carbocaties.
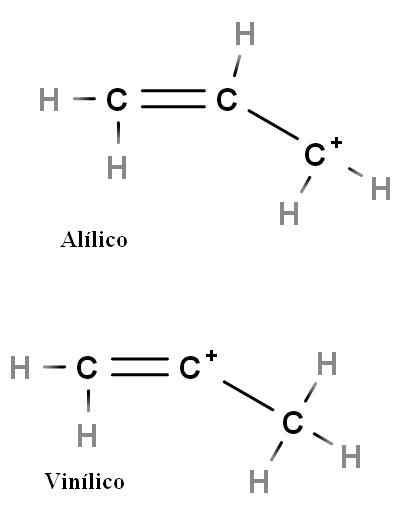
Allylisch en vinyl
 Allylische en vinylcarbocatie. Bron: Gabriel Bolívar.
Allylische en vinylcarbocatie. Bron: Gabriel Bolívar. Andere speciale soorten carbocaties zijn alilisch en vinyl. Het verschil tussen hen (hierboven) is de positie van de positieve lading gerelateerd aan dubbele binding.
In vinylcarbocatie wordt de positieve belasting gevonden in een van de dubbele bindingskoolvesten; Terwijl in Allyic Carbocation, bevindt de positieve belasting zich in de koolstof na de dubbele binding. Het is voldoende om hydrogenen te vervangen door andere groepen en we zullen een enorme familie van bondgenoot en vinylcarbocaties hebben.
Relatieve stabiliteit
Wetende welke de belangrijkste soorten carbocaties zijn, kunnen ze worden besteld op basis van hun relatieve stabiliteit:
Vinyl < Primario < Secundario < Alílico < Terciario < Aromático
Nu kunnen er allische carbocaties zijn die stabieler zijn dan een specifiek tertiair. Alles hangt af van hun substituenten.
Waarom deze stabiliteit? Naar het vermogen van het molecuul om de positieve belasting van carbocatie te verspreiden of te verminderen. Om dit te doen, heb je nauwe atomen nodig die een deel van de elektronische carbocatiedichtheid geven door hyperconjugatie. Ondertussen wordt dit in alumische en aromatische carbocaties bereikt door resonantie.
In het geval van vinylcarbocatie bevindt de positieve belasting zich op een koolstof die al SP was2, wat het erg onstabiel maakt.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Carbocatie. Opgehaald uit: in.Wikipedia.borg
- James Ashenhurst. (20 februari 2020). 3 factoren die carbocaties stabiliseren. Hersteld van: MasterGanicChemistry.com
- Clark Jim. (2000). Carbocaties (of carboniumionen). Hersteld van: chemguide.co.Uk
- Dr. Kennepohl, prof. S. Boer & t. Soderberg. (10 augustus 2020). Carbocatiestructuur en stabiliteit. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- « Concept, kenmerken en voorbeelden van milieu -ethische codes
- De 4 stations van het jaar in Mexico en zijn kenmerken »

