Latente warmte
- 4969
- 521
- Lonnie Rohan
Wat is latente warmte?
Latente warmte is de hoeveelheid warmte die een stof moet absorberen of losmaken om de fysieke conditie of fase te veranderen, waardoor de constante temperatuur tijdens dat proces wordt gehandhaafd,. De hitte die wordt geleverd of vrijgegeven, wordt niet gemanifesteerd, het voelt niet "aanvoelt" zoals gewoonlijk in een temperatuurvariatie; Vandaar de term van latente warmte.
Het latente woord komt van het Latijnse woord "latsenns" wat verborgen betekent, dus de latente hitte gedraagt zich alsof het niet bestaat wanneer de temperatuur constant is. Maar er is: wat er gebeurt is dat het volledig wordt geconsumeerd in de verandering van fase of fysieke conditie.
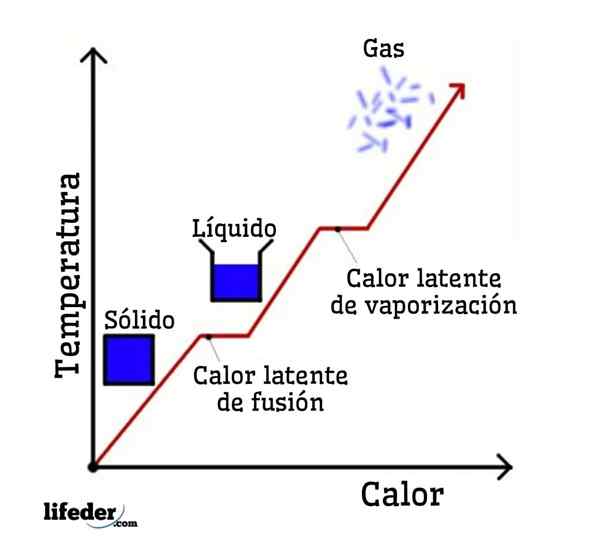
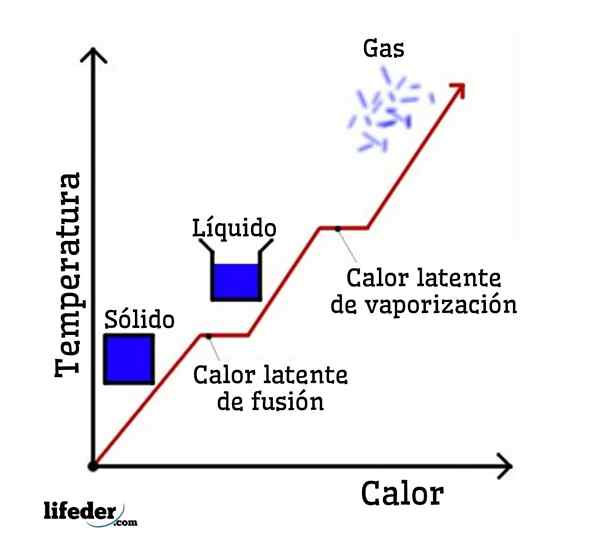
Als water als een voorbeeld wordt genomen, zijn faseveranderingen als volgt: ijs (vaste) smelt tot vloeibaar (vloeibaar) water in een proces dat fusie wordt genoemd; en vloeibaar water verdampt op zijn beurt om te transformeren in waterdamp (gas) in een proces dat verdamping wordt genoemd.
Aan de andere kant wordt waterdamp gekoeld tot vloeibaar water in een proces dat condensatie wordt genoemd; en vloeibaar water wordt weer ijs in een proces dat stolling wordt genoemd.
Elk van deze faseveranderingen heeft een latente warmte geassocieerd, die positief kan zijn (absorptie) of negatief (afgifte).
Latente smeltende warmte
 Verander van vaste stof naar vloeistof; fusie
Verander van vaste stof naar vloeistof; fusie Het is de hoeveelheid warmte die moet worden geleverd aan een bepaalde hoeveelheid vaste stof om zijn fysieke toestand te veranderen van vaste toestand in vloeistof. Tijdens de fusie is er geen temperatuurverandering, dus terwijl de vaste stof is gebaseerd of smelt, heeft de vloeistof die wordt gegenereerd dezelfde temperatuur als de gehele vaste stof.
Over het algemeen wordt deze warmte bepaald in het normale fusiepunt, wat de temperatuur is waarbij de vaste stof begint te fuseren onder atmosferische druk. Bij deze temperatuur is er een gelijktijdige balans of aanwezigheid tegelijkertijd van de vaste toestand en de vloeibare toestand.
Kan u van dienst zijn: categorische variabele: kenmerken en voorbeeldenDe vaste toestand wordt gekenmerkt door de aanwezigheid van een compacte structuur vanwege het bestaan van chemische bindingen met grote energie, die het een structurele stijfheid geven. Voor de transformatie van een vaste stof naar vloeistof moeten deze interacties worden verbroken, dus het wordt voor dat doel geconsumeerd (absorberen) energie.
Een typisch voorbeeld is wanneer een ijs wordt geconsumeerd, gevormd door water, suiker en andere stoffen. Het is gebruikelijk om op te merken dat het ijs, als het niet snel wordt geconsumeerd, begint te smelten, dat wil zeggen, smelten. Dit gebeurt wanneer de ijstemperatuur het smeltpunt van ijs bereikt.
Voorbeelden
Enkele voorbeelden van latente fusion -heats uitgedrukt in J/G worden vermeld; Dat wil zeggen, de energie die een gram vaste stof moet absorberen om op het smeltpunt te smelten:
-Ice 334.0
-380 aluminium.0
-Zwavel 38.1
-Koper 134.0
-Ethanol 104.0
-Mercurius 11.8
-Goud 64.5
-Zilver 80.3
-Lead 24.5
-Wolfraam 184
IJsabsorbeert zeer warmte, niet omdat de interacties sterker zijn, maar omdat het in staat is om uitzonderlijk afwisselende warmte tussen zijn kristallen te dissiperen.
Latente warmte van verdamping
Het is de hoeveelheid warmte die een bepaalde hoeveelheid stof absorbeert om van de vloeibare toestand naar de gasvormige toestand in het normale kookpunt te gaan. Dat wil zeggen, het is de warmte die de vloeistof absorbeert wanneer deze kookt en gas wordt zonder een toename van de temperatuur.
In de boezem van de vloeistof kunnen drugsmoleculen interageren met de vorming van waterstofbruggen en voor aantrekking van de moleculen tussen de moleculen. Om een stof van de vloeibare toestand door te geven aan de gasvormige toestand, moet je deze krachten overwinnen, dus je moet warmte leveren.
De gevoelige warmte wordt degene die de vloeistof alleen absorbeert om de temperatuur te verhogen, wat zal afhangen van de specifieke warmte. Ondertussen wordt de latente verdampingswarmte gebruikt om het direct in stoom te transformeren, een proces dat veel gemakkelijker is op het kookpunt.
Het kan u van dienst zijn: Kalibratiecurve: waar is het voor, hoe het te doen, voorbeeldenVoorbeelden
Hieronder staan voorbeelden van sommige vloeistoffen met hun respectieve latente verdampingswarmtes die opnieuw worden uitgedrukt in J/G:
-Azijnzuur 402
-Aceton 518
-Water 2256
-Ethylalcohol 846
-Zwavel 1510
-Benzeen 390
-Koolstofdioxide 574
-Chloor 293
-Ether 377
-Glycerin 974
-Mercurius 295
-Zuurstof 214
Let op de enorme latente warmte van vloeibaar water: 1 g vloeibaar water (ongeveer 1 ml) moet 2256 J absorberen om te verdampen. Vloeibaar water dissipeert nog steeds de warmte die het veel beter ontvangt in vergelijking met ijs.
Latente stolling warmte
Het is de hitte die een bepaalde hoeveelheid stof moet losmaken om van zijn vloeibare toestand naar zijn vaste toestand te gaan op het punt van stolling of bevriezen. Nogmaals, totdat de vloeistof niet volledig is gestold, blijft de temperatuur constant.
Het stollingsproces is omgekeerd van het fusieproces, dus de waarden van de latente warmte van stolling en die van de latente fusiewarmte zijn gelijk, maar van tegengestelde tekens.
De moleculen van een stof in de vloeibare toestand bewegen met enige vrijheid vanwege de energie die ze hebben. Daarom moeten de moleculen om naar de vaste fase te gaan, energie afgeven in de vorm van warmte, wat een grotere interactie tussen de middelenmoleculen mogelijk maakt.
De interactie tussen de moleculen bevordert de vorming van de chemische bindingen van de vaste fase. Een voorbeeld hiervan gebeurt wanneer vloeibaar water in de containers wordt geplaatst voor ijsvorming in de koelkast van de koelkast. De vriezer extraheert warmte uit vloeibaar water en wordt gestold om ijs te worden.
Voorbeelden
Hieronder staan enkele voorbeelden van latente stollingszittingen (in J/G) voor sommige vloeistoffen:
Kan u van dienst zijn: Witgat: geschiedenis, theorie en hoe het wordt gevormd-Water (-334)
-Aluminium (-380)
-Zwavel (-38)
-Koper (-134)
-Ethanol (-104)
Latente condensatiewarmte
Het is de hoeveelheid warmte die moet worden vrijgegeven of vrijgegeven uit een bepaalde hoeveelheid stof, om van de gastoestand naar de vloeibare toestand te gaan. Het gas dat is gecondenseerd en de gevormde vloeistof behoudt dezelfde temperatuur tijdens condensatie.
Condensatie is een proces in strijd met verdamping. De latente condensatieverwarming heeft dezelfde waarde als de latente verdampingswarmte, maar met het tegenovergestelde teken en op het kookpunt. Een voorbeeld hiervan is wanneer het wordt gekookt en stoom wordt gecondenseerd in het binnenste gezicht van de potten.
Gasvormige moleculen bewegen vrijelijk aangedreven door de energie die ze hebben. Daarom moeten ze energie vrijgeven om de intermoleculaire interacties van de vloeibare toestand te laten vaststellen tussen de moleculen van de stof.
In de natuur zijn er veel andere voorbeelden van het fenomeen watercondensatie. Waterdamp stijgt in de atmosfeer en condenseert in de wolken in de vorm van waterdruppels.
Er is ook de aanwezigheid van waterdruppeltjes in het glas van auto's, product van watercondensatie als gevolg van een temperatuurdaling in de vroege ochtend, die de zo -aangedane rocío vormt.
Voorbeelden
Ten slotte zullen hun respectieve latente condensatie weer uitgedrukt in J/G: worden vermeld voor sommige dampen:
-Azijnzuur (-402)
-Aceton (-518)
-Water (-2256)
-Ethylalcohol (-846)
-Zwavel (-1510)
-Benzeen (-390)
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Walter J. Moore. (1963). Fysische chemie. In chemische kinetiek. Vierde editie, Longmans.
- Wikipedia. (2020). Latente warmte. Opgehaald uit: in.Wikipedia.borg
- De redacteuren van Enyclopaedia Britannica. (2020). Latente warmte. Hersteld van: Britannica.com
- Engineering Toolbox. (2003). Vloeistoffen: latente verdampingswarmte. Opgehaald uit: EngineeringToolbox.com
- Lumen leren. (S.F.)). Faseverandering en weerstandige warmte. Hersteld van: cursussen.Lumenarning.com

